��Ŀ����
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��
CO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��
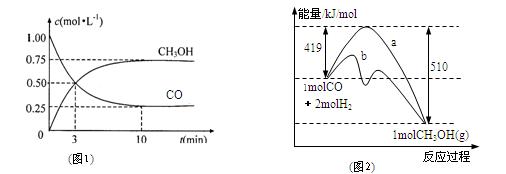
��1���÷�Ӧ��ƽ�ⳣ������ʽΪ��K=
��2��ͼ1�Ƿ�ӦʱCO��CH3OH(g)��Ũ����ʱ��ı仯������ӷ�Ӧ��ʼ��ƽ�⣬��COŨ�ȱ仯��ʾ��ƽ����Ӧ����v(CO��= ��
��3�����˵Ĵ����� ��ѡ����ţ���
a.�ı䷴Ӧ����ЧӦ b.���������ܺ� c.�ӿ췴Ӧ����
d.��߷�Ӧ���ת����
��4����2 L�ܱ������з�����Ӧ CO(g)+2H2(g) ![]() CH3OH(g) ��T��ʱ������2mol CH3OH����Ӧ��ƽ�������CO 1 mol����ʱ��������ͬʱ����2 mol��CH3OH��4mol��H2������壨�����¶Ȳ��䣩����ƽ�⽫ ���������Ӧ���������淴Ӧ���������ƶ����ﵽ��ƽ���ƽ�ⳣ��K��ֵΪ
CH3OH(g) ��T��ʱ������2mol CH3OH����Ӧ��ƽ�������CO 1 mol����ʱ��������ͬʱ����2 mol��CH3OH��4mol��H2������壨�����¶Ȳ��䣩����ƽ�⽫ ���������Ӧ���������淴Ӧ���������ƶ����ﵽ��ƽ���ƽ�ⳣ��K��ֵΪ
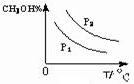
��5�����������£����д�ʩ����ʹn (CH3OH)/n (CO)������� ��ѡ����ţ���
a. �����¶� b. ʹ�ô��� c.�ٳ���2mol H2 d.�ٳ���1mol CO
��6���״�������������ȼ�ϵ�أ��õ���ö�Ķ��Ե缫����Ũ����������Һ��д���õ�صĸ�����Ӧʽ___________________
(1) K=C(CH3OH)/ C(CO) C2 (H2) ��2�֣� (2) 0.075mol/L??min��2�֣�
(3) b��c��2�֣� (4)������Ӧ���� ��2�֣�K=1 (2��) ��5��c��2�֣�
(6)CH![]() OH+8OH
OH+8OH![]() -6e
-6e![]() ��CO
��CO![]() +6H
+6H![]() O��2�֣�
O��2�֣�
����:
��

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�
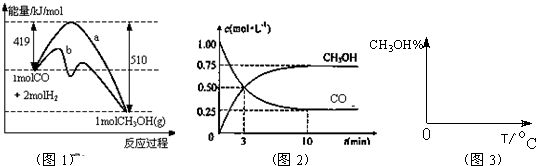
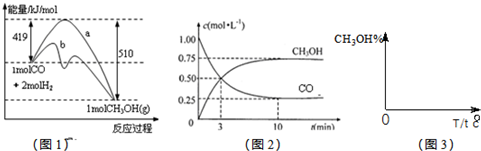
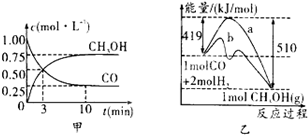
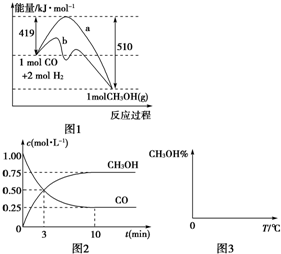 ��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��