题目内容
.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+
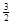 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+
3CO(g)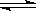 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 1/3Fe2O3(s)+
CO(g)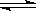 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g)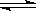 CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
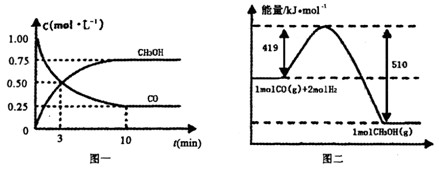
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3 C. 2α1=α2 D. α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___ ____。
I.-23.5(2分) Ⅱ.(1)60%(2分) (2)d(1分)
Ⅲ.(1)0.15mol/(L·min) (2分) (2) A D E (3分)
(3) 正 (2分) (4)CH3OH + 8OH- - 6e- = CO32- + 6H2O. (2分)
【解析】I.考查盖斯定律的应用。根据已知反应可知,①×3/2-②即得到Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),所以反应热是-566 kJ·mol-1×3/2+825.5 kJ·mol-1=-23.5kJ·mol-1。
Ⅱ.设消耗CO设xmol,则生成CO2设xmol,所以平衡时CO和CO2的物质的量分别是1-x和1+x,因此根据平衡常数表达式可知 ,解得x=0.6,即转化率是60%。
,解得x=0.6,即转化率是60%。
由于反应是吸热的、体积不变的可逆反应,因此提高反应温度平衡向逆反应方向移动,改变压强或使用催化剂,平衡不移动。降低生成物浓度,平衡向正反应方向移动,d正确。e不正确,粉碎矿石使其与平衡混合气体充分接触,只能改变反应速率,但不能影响平衡状态,答案选d。
Ⅲ.(1)根据图像可知,平衡时生成甲醇是0.75mol/L,则消耗氢气是1.5mol/L,所以氢气的反应速率是1.5mol/L÷10min=0.15mol/(L·min) 。
(2)1mol CH3OH相当于是1mol CO和2mol H2,所以甲和乙的平衡是等效的,因此选项ADE正确。丙相当于在甲的基础上增大压强,平衡向正反应方向移动,所以应该是.2Q1<Q3,α1<α2,B、C不正确。答案选ADE。
(3)平衡吋测得混合气体的密度是同温同压下起始的1.6倍,这说明气体的体积是减小的,所以反应向正反应方向移动。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于是碱性溶液,所以负极电极反应式为CH3OH + 8OH- - 6e- = CO32- + 6H2O。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案 )+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③ 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。