题目内容
【题目】实验室制取乙酸乙酯的主要步骤如下:
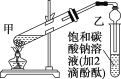
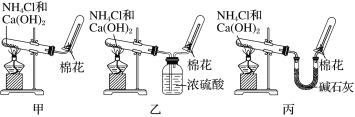
①在甲试管(如图)中加入3mL乙醇、2mL浓硫酸和2mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入碎瓷片,用小火均匀地加热3~5min。
③待试管乙中收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为______;反应中浓硫酸的作用是_____。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应该从仪器的________(填“下口放出”或“上口倒出”)。
【答案】先向试管中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸 做催化剂和吸水剂 CH3COOH+CH3CH2OH![]() H2O+CH3COOCH2CH3 BC 分液漏斗 上口倒出
H2O+CH3COOCH2CH3 BC 分液漏斗 上口倒出
【解析】
根据浓H2SO4比水重,溶于水放出大量的热,为了防止暴沸,将浓H2SO4注入乙醇中,由浓H2SO4特性,判断浓H2SO4的作用;根据乙酸与乙醇发生酯化反应,写出化学方程式;根据Na2CO3可与乙酸反应,溶解乙醇,降低乙酸乙酯的溶解度,判断其作用;根据乙酸乙酯与Na2CO3互不相溶且分层,用分液操作分离,据此解答。
(1)浓硫酸密度大于水,且溶于水放出大量热,为了防止暴沸,应该将浓硫酸加入乙醇中,所以操作方法为:先向试管中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用;答案为先向试管中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,催化剂和吸水剂。
(2)酯化反应中,羧酸脱去羟基,醇脱去氢原子,所以该反应的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;答案为CH3COOH+C2H5OH
CH3COOC2H5+H2O;答案为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以BC正确;答案为BC。
(4)由于乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗,乙酸乙酯密度小于碳酸钠溶液,在上层,分液时从分液漏斗的上口倒出;答案为分液漏斗,上口倒出。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃