题目内容
下列各组离子中在水溶液中能大量共存的是( )
| A.Fe2+、K+、ClO—、Cl— | B.Ag+、Na+、Cl—、NO3- |
| C.NH4+、K+、CO32—、Br— | D.H+、Ca2+、CH3COO—、HCO3— |
C
解析试题分析:Fe2+ 与ClO— 因发生氧化还原反应而不能大量共存,A错误;Ag+与Cl— 生成沉淀不能共存,B错误;C中离子组可以大量共存;H+与CH3COO—生成弱电解质醋酸,与HCO3— 反应生成CO2气体不能大量共存,D错误;故选C。
考点:本题考查的是离子共存问题。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
已知SO32-的还原性大于I-,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍无色,则下列关于溶液组成的判断正确的是
① 肯定不含I- ② 肯定不含Cu2+ ③ 肯定含有SO32- ④ 可能含有I-
| A.①③ | B.①②③ | C.③④ | D.②③④ |
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用足量硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
③另取一定量的原溶液中加人5 mL0. 2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是 ( )
| A.该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有A13+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |
下列表述正确的是
A.含有大量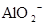 的溶液中:K+、 的溶液中:K+、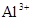 、 、 、 、 可共存 可共存 |
B.CO(g)的燃烧热是283.0kJ· ,则 ,则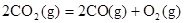 反应的 反应的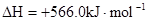 |
C.将SO2通入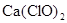 溶液中: 溶液中: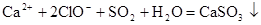 +2HClO +2HClO |
D.在某钠盐溶液中含有等物质的量的 、 、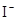 、 、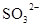 、 、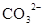 、 、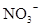 、 、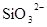 中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有 中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有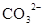 |
下列反应的离子方程式书写正确的是
| A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
B.以石墨作电极电解CuCl2溶液:2Cl-+2H2O  2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.铜跟浓硝酸反应:Cu+4HNO3(浓)= Cu2++2NO3-+2NO↑+2H2O |
| D.NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列各组离子中,能在溶液中大量共存的是
| A.OH-Na+HCO3- Cl- | B.Ba2+ Na+Cl-SO42- |
| C.K+ Al3+ SO42-OH- | D.Ag+Al3+ NO3- H+ |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是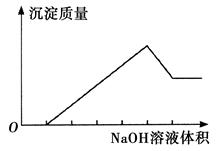
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列反应的离子方程式中,书写正确的是
A.氯气溶于水: |
B.将铝粉投入氢氧化钠溶液中: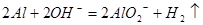 |
C.铜与氯化铁溶液反应: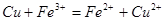 |
D.过氧化钠与水反应: |
在溶液中加入过量Na2O2后仍能大量共存的离子组是
| A.Fe2+、NH4+、Cl-、NO3- | B.K+、CO32-、Cl-、SO42- |
| C.Ca2+、Na+、NO3-、HCO3- | D.Na+、H+、Cl-、Br- |