题目内容
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原 成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是: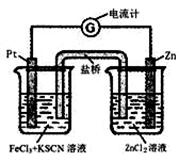
| A.正极反应为Zn-2e-→Zn2+ |
| B.左烧杯中溶液的红色变浅 |
| C.Pt电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
B
解析试题分析:该原电池反应为Zn+2FeCl3=2FeCl2+ZeCl2,则负极为Zn,该反应不生成气体,阳离子移动到正极,左边烧杯中发生Fe3++e-=Fe2+,以此来解答。A、原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以该原电池的正极反应是Fe3++e-=Fe2+,负极反应为Zn-2e-=Zn2+,故A错误;B、左边烧杯中发生Fe3++e-=Fe2+,则左烧杯中溶液的红色逐渐褪去,故B正确;C、该原电池反应为Zn+2FeCl3=2FeCl2+ZeCl2,该反应不生成气体,故C错误;D、将正负极电极反应式合并即得到总反应为Zn+2FeCl3=2FeCl2+ZeCl2,故D不正确,答案选B。
考点:考查原电池原理的有关判断和应用

某小组为研究电化学原理,设计如下图装置,下列叙述不正确的是 
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=" Cu" |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极, 溶液中的Cu2+向铜电极移动 |
将0.1 L含有0.02mol CuSO4和0.01mol NaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
| A.只有Cl2 | B.只有O2 | C.只有H2 | D.既有Cl2又有O2 |
埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速率最慢的是
| A.在潮湿疏松的土壤中 | B.在含铁元素较多的酸性土壤中 |
| C.在干燥致密不透气的土壤中 | D.在含碳较多的潮湿透气的中性土壤中 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时覆盖PbO2的电极为正极,发生还原反应 |
| B.放电时电解质溶液中的H+向正极移动 |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.充电时电解质溶液的pH逐渐增大 |
金属的防腐常用方法有:
| A.覆盖油脂; | B.覆盖油漆; | C.覆盖塑料; | D.电镀金属; E.电化学保护法; F.制成不锈钢。请为以下钢铁制品选择一种适当的防锈方法(填写序号 ): |
(4)电线 ,(5)铁钳的转动部位 ,(6)自行车的钢圈 。
关于下列装置说法正确的是 
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Sn,Sn为正极有气泡生成 |
已知空气-锌电池的电极反应为:锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2 + 2H2O + 4e-=4OH- 根据此判断,锌片是:( )
| A.负极,并被还原 | B.负极,并被氧化 |
| C.正极,并被氧化 | D.正极,并被还原 |
用惰性电极电解200 mLCuSO4溶液。通电一段时间后,测定两极均产生224mL气体(已换算至标准状况下,且忽略溶液体积的变化及气体在溶液中的溶解),则原溶液中溶质的物质的量浓度和所得溶液的pH为
| A.0.04 mol·L-1 1 | B.0.02 mol·L-1 2 |
| C.0.03 mol·L-1 5 | D.0.05 mol·L-1 1 |