题目内容
某小组为研究电化学原理,设计如下图装置,下列叙述不正确的是 
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=" Cu" |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极, 溶液中的Cu2+向铜电极移动 |
D
解析试题分析:A选项a和b不连接时,未构成原电池,但金属铁可以置换金属铜,正确。B选项a和b用导线连接时构成原电池,a作正极,b作负极。正确。C选项都会发生Fe + Cu2+ = Fe2+ + Cu,区别为能量转化方式不同,但溶液蓝色都会变成浅绿色,正确。D选项Cu2+作为阳离子应向阴极移动,b连接直流电源负极作阴极,错误。
考点:原电池和电解池的构成。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )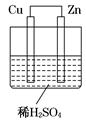
| 卡片号:2 2013.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③SO42– 向Cu极移动 ④ 若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤ 电子的流向是:Cu→Zn ⑥正极反应式:Cu +2e- = Cu2+ |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列 有关说法中不正确的是( )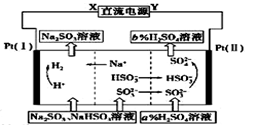
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )
| A.充电时阳极附近溶液的酸性减弱 |
| B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O |
| C.放电过程中电解质溶液中阳离子移向负极 |
| D.放电时每转移1mol电子,负极有1mol V2+被氧化 |
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )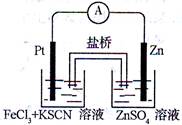
| A.该原电池的正极反应是:Zn-2e— =Zn2+ |
| B.Pt电极表面生成大量气泡 |
| C.左烧杯中溶液的红色逐渐褪去 |
| D.生成的Fe2+通过盐桥可以和锌直接反应生成Fe |
用惰性电极实现电解,下列说法中正确的是 ( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,阴极和阳极产物的物质的量之比为1∶1 |
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原 成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是: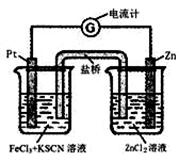
| A.正极反应为Zn-2e-→Zn2+ |
| B.左烧杯中溶液的红色变浅 |
| C.Pt电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
