题目内容
用惰性电极电解200 mLCuSO4溶液。通电一段时间后,测定两极均产生224mL气体(已换算至标准状况下,且忽略溶液体积的变化及气体在溶液中的溶解),则原溶液中溶质的物质的量浓度和所得溶液的pH为
| A.0.04 mol·L-1 1 | B.0.02 mol·L-1 2 |
| C.0.03 mol·L-1 5 | D.0.05 mol·L-1 1 |
D
解析试题分析:电解硫酸铜时,
阳极:2H2O -4e- =O2↑ + 4H+;
0.04mol 0.01mol 0.04mol
阴极:Cu2+ +2e-=Cu; 2H2O-2e- =H2↑ + 2OH-;
0.01mol 0.02mol 0.02mol 0.01mol 0.02mol
也就是说先电解硫酸铜,再电解水。依题意可知,
阳极上产生224mL气体是氧气,转移电子数为0.04mol;此时阴极上要想生成224mL氢气,转移只能是0.02mol,而在一个电路中转移的电子是相等的,所以铜所得到的电子为0.02mol,那说明铜离子的物质的量为0.01mol,因此,硫酸铜的浓度为: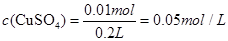 溶液中的:
溶液中的:
所以所得溶液的pH为:pH=1
考点:电解的有关知识。

298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原 成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是: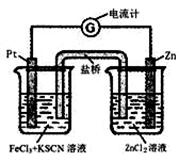
| A.正极反应为Zn-2e-→Zn2+ |
| B.左烧杯中溶液的红色变浅 |
| C.Pt电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是( )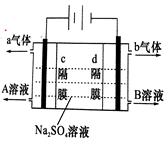
| A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
| B.A溶液为硫酸,B溶液为氢氧化钠 |
| C.a气体为氢气,b气体为氧气 |
D.该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑ 2H2SO4+4NaOH+O2↑+2H2↑ |
用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,电解过程中不可能发生的反应是
A.2Cl-+Cu2+ Cu+Cl2↑ Cu+Cl2↑ |
B.2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
C.2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液H+增大 |
| B.烧杯b中发生氧化反应 |
| C.烧杯a中发生的反应为:2H+ +2e-=H2 |
| D.烧杯b中发生的反应为:2Cl--2e-=Cl2 |
下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C Li1-xCoO2+LixC6。下列有关说法正确的是
Li1-xCoO2+LixC6。下列有关说法正确的是
| A.放电时,负极反应LiCoO2 – xe- =Li(1-x)CoO2 + xLi+ |
| B.充电时,A极发生氧化反应 |
| C.充电时,Li+穿过隔离膜向B极移动 |
| D.当B极失去Xmol电子,电池消耗 6 mol C |
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是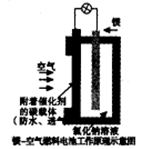
| A.该电池Mg作负极,发生还原反应 |
B.该电池的正极反应式为: |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L |
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
| A.阴极(Cu片)2C1――2e-=Cl2↑ |
| B.正极(石墨棒):Fe3+ +e-= Fe2+ |
| C.阳极(Cu片):4OH――4e-=2H2O+O2↑ |
| D.负极(Fe钉):Fe-3e-=Fe3+ |
下图装置可用来监测空气中NO的含量,下列说法正确的是 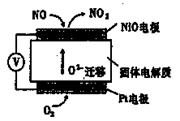
| A.电子由Pt电极流出,经外电路流向NiO电极 |
| B.Pt电极上发生的是氧化反应 |
| C.NiO电极的电极反应式为NO+O2——2e—= NO2 |
| D.每流经l m3空气(假设NO被完全吸收),转移电子的物质的量为2 ×l0—7mol,则该空气中NO的含量约为3×10—2mg/m3 |