题目内容
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是_________(用离子方程式表示)
(2)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_________________。
(3)室温下将0.12 mol/L HCl溶液与0.1 mol/L NaOH溶液等体积混合,混合液的pH=_____。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ Fe3++3HCO3-= Fe(OH)3↓+3CO2↑ 2
Al(OH)3(胶体)+3H+ Fe3++3HCO3-= Fe(OH)3↓+3CO2↑ 2
【解析】
(1)明矾是利用Al3+水解产生的氢氧化铝晶体的吸附性来净水;
(2)根据盐水解的酸碱性,结合盐的水解规律分析;
(3)HCl与NaOH发生中和反应,先根据二者物质的量的多少判断HCl过量,计算反应后溶液中c(H+),然后根据pH=-lgc(H+)计算。
(1)明矾是强酸弱碱盐,溶于水电离产生Al3+,Al3+发生水解作用:Al3++3H2O![]() Al(OH)3(胶体)+3H+,胶体表面积大,吸附力强,能够吸收水中悬浮的固体小颗粒,使之形成沉淀而从水中分离除去,从而具有净水作用;
Al(OH)3(胶体)+3H+,胶体表面积大,吸附力强,能够吸收水中悬浮的固体小颗粒,使之形成沉淀而从水中分离除去,从而具有净水作用;
(2) 向FeCl3溶液中滴加NaHCO3溶液,Fe3+、HCO3-发生水解作用,且由于这两种离子水解后溶液的酸碱性相反,相互促进,使离子水解程度增大,甚至完全,最终形成Fe(OH)3沉淀和CO2气体,反应的离子方程式为:Fe3++3HCO3-= Fe(OH)3↓+3CO2↑;
(3)HCl与NaOH在溶液中发生中和反应:HCl+NaOH=NaCl+H2O,二者反应的物质的量的比是1:1,由于c(HCl)=0.12 mol/L,c(NaOH)=0.1 mol/L,二者等体积混合,所以反应后HCl过量,反应后溶液中c(H+)=(0.12 mol/L-0.1 mol/L)÷2=0.01 mol/L,则溶液的pH=-lgc(H+)=2。

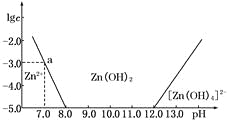
【题目】如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl) | |||||||
(mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103c(PbCl2) | |||||||
(mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
D.PbCl2固体可溶于饱和食盐水 |
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。