题目内容
【题目】I.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

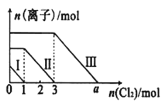
(1)一定条件下,NO与NO2存在下列反应:NO(g) + NO2(g) ![]() N2O3(g),其平衡常数表达式为K = ____。
N2O3(g),其平衡常数表达式为K = ____。
(2)吸收时,尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋,好处是____。
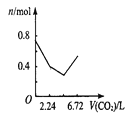
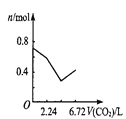
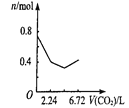
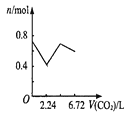
(3)为提高Ca(NO2)2的产率及纯度,则n(NO)∶n(NO2)应控制为____。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为___。
II.铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原—氯化法可实现由铝土矿制备金属铝,相关的热化学方程式如下:
Al2O3(s) + AlCl3(g) + 3C(s) =3AlCl(g) + 3CO(g) △H = a kJ·mol—1
3AlCl (g)=2Al(l) + AlCl3(g) △H = bkJ·mol—1
则Al2O3(s) + 3C(s) =2Al(l) + 3CO(g) △H = __kJ·mol—1(用含a、b的代数式表示)。
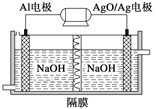
(2)铝电池性能优越,Al—AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为____。
【答案】c(N2O3)/[c(NO)·c(NO2)] 使尾气中NO、NO2被充分吸收 1:1 3NO2-- + 2H+ =NO3-- + 2NO ↑+ H2O a+b 2Al+3AgO+2NaOH= 2NaAlO2 +3Ag + H2O
【解析】
I.由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在;
(1)结合反应及在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值表示K;
(2)可增大反应物的接触面积,提高吸收率;
(3)若n(NO):n(NO2)>1:1,则一氧化氮过量,若n(NO):n(NO2)<1:1,则Ca(NO2)2中混有Ca(NO3)2;
(4)根据NO2-被还原成NO,说明还有NO2-被氧化成NO3-,根据得失电子守恒、原子守恒、电荷守恒书写离子方程式;
II.(1)根据盖斯定律,将题中所给两热化学方程式相加即可;
(2)该电池中铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,AgO做正极,得电子被还原为Ag,据此书写方程式。
I.由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在;
(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,则反应NO(g)+NO2(g)N2O3(g)的平衡常数表达式为K= c(N2O3)/[c(NO)·c(NO2)];
(2)吸收时,尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋,使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;
(3)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高,产率低;若n(NO):n(NO2)<1:1,则还会有二氧化氮与石灰乳生成Ca(NO3)2的反应,影响产品纯度,故为提高Ca(NO2)2的产率及纯度, n(NO)∶n(NO2)应控制为1:1;
(4)反应物是NO2-和H+,生成物是一氧化氮,NO2-被还原成NO,说明还有NO2-被氧化成NO3-,根据得失电子守恒、原子守恒、电荷守恒,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O;
II.(1)已知:①Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJmol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol-1
根据盖斯定律,①+②得Al2O3(s)+3C(s)=2Al(l)+3CO(g) △H=(a+b)kJmol-1;
(2)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,AgO做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。

【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: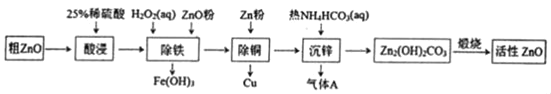
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O