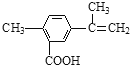
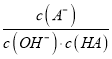题目内容
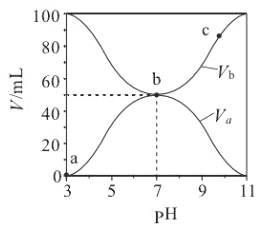
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
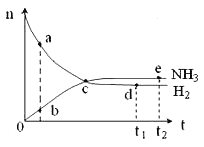
A. 点a的n(H2)和点b的n(NH3)比值为3∶2
B. 点 c处反应达到平衡
C. 点d (t1时刻)和点 e (t2时刻) 处n(N2)不一样
D. 其他条件不变,773K下反应至t1时刻,n(H2)比右图中d点的值大
【答案】D
【解析】
A.根据图像,只能判断,点a的n(H2)和点b的n(NH3)大,无法判断比值,故A错误;B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;D.该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;故选D。

 阅读快车系列答案
阅读快车系列答案【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183 kJ/mol
2NO(g) ΔH = +183 kJ/mol
2H2(g) + O2(g) === 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) === 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = ___________ kJ/mol
2NH3(g) ΔH = ___________ kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
① 按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=_________________(只需代入数据,不用计算结果)
② 按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式:________________________