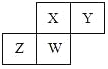题目内容
【题目】短周期元素W、X、Y、Z的原子序数依次增大,Y的原子半径是短周期主族元素中最大的,元素W的最外层电子数是次外层的2.5倍,元素X的最外层电子数是电子层数的3倍,元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂。
(1)元素W、X、Y、Z的符号分别是______,______,______,______。
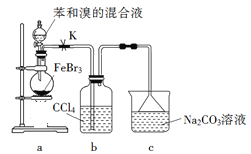
(2)实验中制备Z单质的反应方程式为 ________________________。
(3)Z单质与X的氢化物发生反应的化学方程式为 __________________ 。若将干燥的有色布条放入Z的单质中,观察到的现象是 ___________________,原因是__________。
(4)Z单质与Y的最高价氧化物的水化物反应的化学方程式是_______,该反应中2mol Z完全反应时转移电子的数目_______ NA。
(5)实验中制备W的氢化物的反应方程式为 _________________。
【答案】N O Na Cl ![]()
![]() 有色布条未褪色 干燥的氯气没有漂白性
有色布条未褪色 干燥的氯气没有漂白性 ![]() 2
2 ![]()
【解析】
(1)Y的原子半径是短周期主族元素中最大的,Y为Na元素;元素W的最外层电子数是次外层的2.5倍,W为N元素;X最外层电子数是电子层数的3倍,X为O元素;元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂,Z为Cl元素;
(2)实验室制Cl2的原理为:![]() ;
;
(3)X的氢化物为H2O,则Cl2与H2O反应的化学方程式为:![]() ,因干燥的氯气没有漂白性,所以干燥的有色布条在氯气中不褪色;
,因干燥的氯气没有漂白性,所以干燥的有色布条在氯气中不褪色;
(4)Y的最高价氧化物的水化物为NaOH,则Z单质与Y的最高价氧化物的水化物发生反应的化学方程式为![]() ;当反应1molCl2时,转移1mol电子,该反应中2mol Cl2完全反应时转移2NA个电子;
;当反应1molCl2时,转移1mol电子,该反应中2mol Cl2完全反应时转移2NA个电子;
(5)W的氢化物为NH3,实验室制备氨气的化学方程式为![]() 。
。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案