题目内容
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的原子序数是其最外层电子数的三倍,下列说法正确的是( )
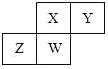
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Y、Z、W的最高化合价分别与其主族序数相等
【答案】C
【解析】
由图可知,X、Y为第二周期元素,Z、W为第三周期元素,设W的最外层电子数为a,W原子的原子序数是其最外层电子数的三倍,则10+a=3a,解得a=5,W为P元素,则X、Y、Z、W分别为N、O、Si、P。
A. 同一周期从左往右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,原子半径大小关系为Z>W>X>Y,A错误;
B. Z、W、X最高价氧化物对应水化物分别为![]() ,同周期从左到右最高价氧化物对应的水化物酸性逐渐增强,同主族从上到下最高价氧化物对应的水化物酸性逐渐减弱,则酸性强弱为:X>W>Z,B错误;
,同周期从左到右最高价氧化物对应的水化物酸性逐渐增强,同主族从上到下最高价氧化物对应的水化物酸性逐渐减弱,则酸性强弱为:X>W>Z,B错误;
C. 同一周期从左往右,同一主族从下往上,最简单气态氢化物的热稳定性逐渐增强,则最简单气态氢化物的热稳定性:Y>X>W>Z,C正确;
D.O元素没有+6价,与其主族序数不相等,D错误;
答案选C。

【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D