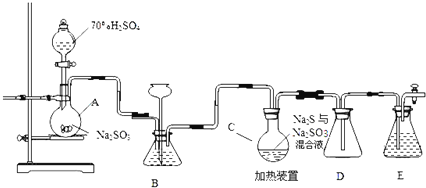
题目内容
【题目】下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
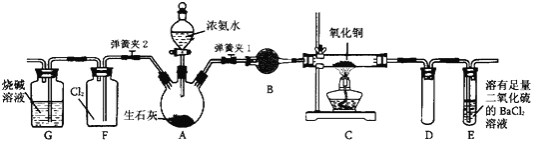
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
【答案】关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水 碱石灰 白色沉淀 2NH3+3CuO![]() 3Cu+N2+3H2O Cu2O、Cu 3Cl2+8NH3===N2+6NH4Cl 盛满氯气的集气瓶中因与氨气反应消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸 如果氨水是强碱,0.10mol·L-1氨水pH为13,而溶液的pH=10<13,所以一水合氨是弱碱 溶液的颜色变浅
3Cu+N2+3H2O Cu2O、Cu 3Cl2+8NH3===N2+6NH4Cl 盛满氯气的集气瓶中因与氨气反应消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸 如果氨水是强碱,0.10mol·L-1氨水pH为13,而溶液的pH=10<13,所以一水合氨是弱碱 溶液的颜色变浅
【解析】
(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡;
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(4)生成的红色物质可能为Cu2O、Cu或二者混合物,反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、氧元素质量确定组成,进而计算n(Cu):n(O)确定组成;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸。
(1)由图可知,在检查装置气密性时,先将弹簧夹2关闭,同时关闭分液漏斗的活塞,打开弹簧夹1,在E中装如水;
(2)装置A中制备出氨气,B用于干燥氨气,氨气属碱性气体,应用碱性干燥剂碱石灰干燥;
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关 闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,说明氨气还原了氧化铜,反应方程式为2NH3+3CuO![]() 3Cu+N2+3H2O,同时E中还会出现白色沉淀;
3Cu+N2+3H2O,同时E中还会出现白色沉淀;
(4)由题意可得,16gCuO中含Cu的质量为![]() ,那么含O的质量为16-12.8=3.2g,反应后称量固体质量减少2.4g,则剩余固体的质量为16-2.4=13.6g>12.8g,说明剩余的固体中即含有Cu,又含有O,故有n(Cu)=
,那么含O的质量为16-12.8=3.2g,反应后称量固体质量减少2.4g,则剩余固体的质量为16-2.4=13.6g>12.8g,说明剩余的固体中即含有Cu,又含有O,故有n(Cu)=![]() =0.2mol,n(O)=
=0.2mol,n(O)=![]() =0.05mol,那么n(Cu):n(O)=4:1>2:1,所以固体的成分是Cu2O、Cu;
=0.05mol,那么n(Cu):n(O)=4:1>2:1,所以固体的成分是Cu2O、Cu;
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,该白烟为氯化铵,化学反应方程为3Cl2+8NH3===N2+6NH4Cl;G中溶液倒吸,是因为盛满氯气的集气瓶中因与氨气反应消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸;
(6)①测得室温下0.lmol/L氨水pH为10,说明一水合氨为弱碱,因为如果是强碱,pH应为13而不是10;②取出10mL0.1mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,由于NH4Cl晶体是弱电解质,不完全电离,由于同离子效应,抑制了氨水的电离,使OH-浓度减小,则可观察到溶液颜色变浅。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
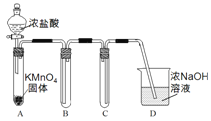
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。