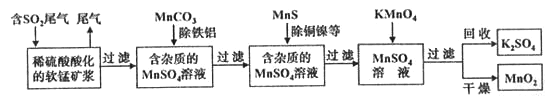
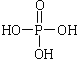
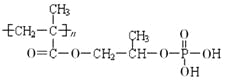
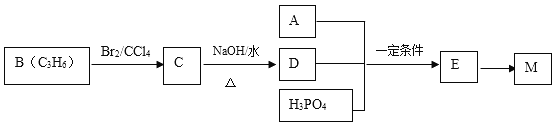
��Ŀ����
����Ŀ��ԭ���������������X��Y��Z��W���ֶ�����Ԫ�أ�X��Wԭ�ӵ�����������������Ӳ�����ȣ�X�ֱ���Y��Z�γ�10���ӵĻ�����P��Q��P��ʹʪ��ĺ�ɫʯ����ֽ������Q��������һ��Һ�塣����˵����ȷ����
A. �����Ӱ뾶��С��ϵΪW>Z
B. P�γɵ�ˮ��Һ�ܵ��磬˵��P���ڵ����
C. ���W���Ȼ���ˮ��Һ���Եõ�W����
D. ��X��Y��Z��ɵ��ε�ˮ��Һ�����ԣ�����Һ�и���������Ũ��С���������Ũ��
���𰸡�D
��������X��Wԭ�ӵ�����������������Ӳ�����ȣ�X��WӦ��H��Be��Al���������� ��X�ֱ���Y��Z�γ�10���ӵĻ�����P��Q��P��QΪ�⻯����XΪH��P��ʹʪ��ĺ�ɫʯ����ֽ������PΪNH3����YΪN��Q��������һ��Һ�壬QΪH2O����ZΪO����WΪAl��A����Z��W��������O2����Al3�������ǵ��Ӳ��Ų���ͬ�������Ų���ͬ���뾶����ԭ�������ĵ�������С��������Ӱ뾶O2��>Al3������A����B��PΪNH3��������ˮ��Һ��Ȼ�ܹ����磬����Һ�����Ӳ���NH3������������NH3���ǵ���ʣ���B����C����ҵ�ϵ�����ڵ�������ұ�������ʣ���C����D����ɵĻ�������NH4NO3��NH4������ˮ�⣬NH4����H2O ![]() NH3��H2O��H�������c(NH4��)<V(NO3��)����D��ȷ��
NH3��H2O��H�������c(NH4��)<V(NO3��)����D��ȷ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������Ϊ����ѧ��Ӧԭ��(ѡ��4)��ѡ���⡣
(1)��һ�̶��ݻ����ܱ������н������·�Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���£�
CO(g)��H2O(g)����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���£�
T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��K�ı���ʽΪ____________________��
�ڸ÷�Ӧ������ӦΪ__________��Ӧ(�����ȡ����ȡ�)��
������ѡ���У����жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����____________(����ĸ����)��
A��������ѹǿ����
B�����������COŨ�Ȳ���
C��v��(H2)��v��(H2O)
D��c(CO2)��c(CO)
(2)���л������HCl����NaOH����CH3COOH����NH3��H2O����CH3COONa����NH4Cl����Һ�ʼ��Ե���__________(�����)��������0.01 mol/L HCl��Һ��pH��________��pH��11��CH3COONa��Һ����ˮ���������c(OH��)��________��
(3)��֪��Cu2����Mg2����Fe2��Ũ����ͬ����Һ�У��俪ʼ����ʱ��pH���£�
���� | Fe2�� | Cu2�� | Mg2�� |
pH | 7.6 | 5.2 | 10.4 |
���������Һ�еμ�NaOH��Һ�����ȳ������� ____________(�����ӷ���)��
���ж�Ksp[Fe(OH)2] ____________Ksp[Mg(OH)2](�����������������)��
(4)���װ����ͼ��ʾ��

�ٵ��ö��Ե缫���ʱ��d�缫�ķ�ӦʽΪ____________________��
�����ô�װ�ý������϶�ͭ����֪�Ʋ�������ô�ͭ�ҵ��ǰ���缫����������ȣ����һ��ʱ���Ե缫���г�����������������Ϊ16 g�����·��ת�Ƶĵ���Ϊ____________mol��