��Ŀ����
����Ŀ������Ϊ����ѧ��Ӧԭ��(ѡ��4)��ѡ���⡣
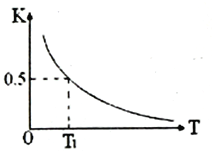
(1)��һ�̶��ݻ����ܱ������н������·�Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���£�
CO(g)��H2O(g)����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���£�
T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��K�ı���ʽΪ____________________��
�ڸ÷�Ӧ������ӦΪ__________��Ӧ(�����ȡ����ȡ�)��
������ѡ���У����жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����____________(����ĸ����)��
A��������ѹǿ����
B�����������COŨ�Ȳ���
C��v��(H2)��v��(H2O)
D��c(CO2)��c(CO)
(2)���л������HCl����NaOH����CH3COOH����NH3��H2O����CH3COONa����NH4Cl����Һ�ʼ��Ե���__________(�����)��������0.01 mol/L HCl��Һ��pH��________��pH��11��CH3COONa��Һ����ˮ���������c(OH��)��________��
(3)��֪��Cu2����Mg2����Fe2��Ũ����ͬ����Һ�У��俪ʼ����ʱ��pH���£�
���� | Fe2�� | Cu2�� | Mg2�� |
pH | 7.6 | 5.2 | 10.4 |
���������Һ�еμ�NaOH��Һ�����ȳ������� ____________(�����ӷ���)��
���ж�Ksp[Fe(OH)2] ____________Ksp[Mg(OH)2](�����������������)��
(4)���װ����ͼ��ʾ��

�ٵ��ö��Ե缫���ʱ��d�缫�ķ�ӦʽΪ____________________��
�����ô�װ�ý������϶�ͭ����֪�Ʋ�������ô�ͭ�ҵ��ǰ���缫����������ȣ����һ��ʱ���Ե缫���г�����������������Ϊ16 g�����·��ת�Ƶĵ���Ϊ____________mol��
���𰸡� ![]() ���� BC �ڢܢ� 2 1��10��3mol��L��1 Cu2�� �� Cu2����2e��===Cu 0.25
���� BC �ڢܢ� 2 1��10��3mol��L��1 Cu2�� �� Cu2����2e��===Cu 0.25
����������1�����黯ѧƽ�ⳣ����Ӱ�컯ѧƽ���ƶ������ء���ѧƽ��״̬���жϣ��ٸ���ƽ�ⳣ���Ķ��壬�˷�Ӧ��ƽ�ⳣ��K=![]() ���ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ����¶����ߣ�K���ͣ�˵����Ӧ���淴Ӧ������У����˷�Ӧ���������Ƿ��ȷ�Ӧ����A����Ӧǰ������ϵ��֮����ȣ�ѹǿ���䣬����˵����Ӧ�ﵽƽ�⣬��A����B�����ݻ�ѧƽ��״̬�Ķ��壬COŨ�Ȳ��ٸı�˵����Ӧ�ﵽƽ�⣬��B��ȷ��C��v��(H2)������Ӧ������У�v��(H2O)���淴Ӧ������У������ǵ�����֮�ȵ��ڻ�ѧ������֮�ȣ�˵����Ӧ�ﵽƽ�⣬��C��ȷ��D����֪����ʼʱͨ��CO2��H2�������������Ũ����ȣ�����˵����Ӧ�ﵽƽ�⣬��D����2��������Һ����ԡ�pH�ļ��㣬��HCl����Һ�����ԣ��ʢٴ���NaOH�Ǽ�ʢ���ȷ����CH3COOH�����ᣬ�ʢ۴���NH3��H2O�Լ��ԣ��ʢ���ȷ������ǿ�������Σ�ˮ��Һ�Լ��ԣ��ʢ���ȷ��������ǿ�������Σ�ˮ��Һ�����ԣ��ʢ���������������Һ�Լ��Ե��Ǣڢܢݣ�����pH=��lgc(H��)����ʱ��Һ��c(H��)=0.01mol��L��1����pH=2��ˮ�����һ����H����CH3COO���������CH3COOH����Һ��OH����ȫ����ˮ�����������c(OH��)=Kw/c(H��)=10��14/10 ��11mol��L��1=10��3mol��L��1�� ��3�������ܶȻ���Ӧ�ã������������ӵ�ˮ��Һ�����ԣ����ݿ�ʼ���ֳ�����pH��pHԽС������NaOH��Һ�����ȳ��ֳ�������Cu2���Գ��������ȳ�����˵���ܶȻ�С�����Ksp[Fe(OH)2]<Ksp[Mg(OH)2]����4��������ԭ�����缫��Ӧʽ����д����d�缫���ӵ�Դ�ĸ�����d�缫Ϊ���������ݵ��ԭ���������缫��ӦʽΪCu2����2e��=Cu���ڵ��ʱ��������������ͭ��������������ӦʽΪCu2����2e��=Cu��������ӦʽΪCu��2e��=Cu2��������������Ϊ16g��˵����8gCu�μӷ�Ӧ����ת�Ƶ������ʵ���Ϊ8��2/64mol=0.25mol��
���ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ����¶����ߣ�K���ͣ�˵����Ӧ���淴Ӧ������У����˷�Ӧ���������Ƿ��ȷ�Ӧ����A����Ӧǰ������ϵ��֮����ȣ�ѹǿ���䣬����˵����Ӧ�ﵽƽ�⣬��A����B�����ݻ�ѧƽ��״̬�Ķ��壬COŨ�Ȳ��ٸı�˵����Ӧ�ﵽƽ�⣬��B��ȷ��C��v��(H2)������Ӧ������У�v��(H2O)���淴Ӧ������У������ǵ�����֮�ȵ��ڻ�ѧ������֮�ȣ�˵����Ӧ�ﵽƽ�⣬��C��ȷ��D����֪����ʼʱͨ��CO2��H2�������������Ũ����ȣ�����˵����Ӧ�ﵽƽ�⣬��D����2��������Һ����ԡ�pH�ļ��㣬��HCl����Һ�����ԣ��ʢٴ���NaOH�Ǽ�ʢ���ȷ����CH3COOH�����ᣬ�ʢ۴���NH3��H2O�Լ��ԣ��ʢ���ȷ������ǿ�������Σ�ˮ��Һ�Լ��ԣ��ʢ���ȷ��������ǿ�������Σ�ˮ��Һ�����ԣ��ʢ���������������Һ�Լ��Ե��Ǣڢܢݣ�����pH=��lgc(H��)����ʱ��Һ��c(H��)=0.01mol��L��1����pH=2��ˮ�����һ����H����CH3COO���������CH3COOH����Һ��OH����ȫ����ˮ�����������c(OH��)=Kw/c(H��)=10��14/10 ��11mol��L��1=10��3mol��L��1�� ��3�������ܶȻ���Ӧ�ã������������ӵ�ˮ��Һ�����ԣ����ݿ�ʼ���ֳ�����pH��pHԽС������NaOH��Һ�����ȳ��ֳ�������Cu2���Գ��������ȳ�����˵���ܶȻ�С�����Ksp[Fe(OH)2]<Ksp[Mg(OH)2]����4��������ԭ�����缫��Ӧʽ����д����d�缫���ӵ�Դ�ĸ�����d�缫Ϊ���������ݵ��ԭ���������缫��ӦʽΪCu2����2e��=Cu���ڵ��ʱ��������������ͭ��������������ӦʽΪCu2����2e��=Cu��������ӦʽΪCu��2e��=Cu2��������������Ϊ16g��˵����8gCu�μӷ�Ӧ����ת�Ƶ������ʵ���Ϊ8��2/64mol=0.25mol��

 ��У����ϵ�д�
��У����ϵ�д�