题目内容
在一定温度下,可逆反应A(气)+3B(气)  2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )
A.A、B、C的分子数比为132
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等
D.单位时间生成n mol A,同时生成3n mol B
C
解析试题分析:对于一个可逆反应,达到化学平衡的特征为1.正反应速率等于逆反应速率。2.各物质的浓度保持不变。A选项,各物质在达到化学平衡时不一定是按化学计量数的比例存在。所以A选项是错误的。B选项是各物质的浓度保持不变,不是相等,所以B 选项是错误的。D应该为单位时间生成n mol A,同时消耗3n mol B
考点:考查判断一个可逆反应达到平衡标志的相关知识点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案保持相同的温度,可逆反应 2A (g) + B(g) 2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
| A.大于 | B.小于 | C.等于 | D.无法确定 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
| A.60 s内X的平均反应速率为0.001 mol·L-1·s-1 |
| B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )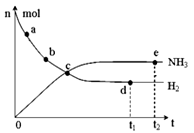
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.点d和点e处的n(N2)不相同 |
| D.点e反应达到化学平衡状态,反应停止 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1 |
在t℃时,10mL0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
| t /min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
A.0~2min H2O2平均反应速率比4~6min快
B.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.3mol·L-1
D.反应至6min时,H2O2分解了50%
(10分)800℃时在2L密闭容器内反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)下图中表示NO2的变化的曲线是________,
用O2表示从0~2s内该反应的平均速率v(O2)=_____。
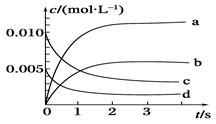
(3)能说明该反应一定达到平衡状态的是_ _
A.v(NO2)=2v(O2) B.容器内颜色保持不变
C.2V逆 (NO)=v正(O2) D.容器内压强保持不变
(4)能增大该反应的反应速率是
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
反应X(g)+Y(g) 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是