题目内容
反应X(g)+Y(g) 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
D
解析试题分析:A、该反应为反应前后气体物质的量不变的反应,减小容器体积相当于增大压强,平衡不移动,错误;B、加入催化剂,平衡不移动,Z的产率不变,错误;C、反应物不只一种,增大c(X),X的转化率减小,错误;D、该反应为放热反应,降低温度,平衡正向移动,Y的转化率增大,正确。
考点:考查外界条件对化学平衡的影响。

练习册系列答案
相关题目
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2
⑤恒压下充入N2能够使反应速率增大的措施是( )
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是( )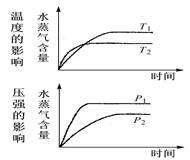
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0 CO(NH2)2(s)+H2O(g); △H<0 |
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0 CO(g)+H2O(g); △H>0 |
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0 CH2=CH2(g)+ H2O(g); △H>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0 2C6H-5CH=CH2(g)+2H2O(g); △H<0 |
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示。
下列说法不正确的是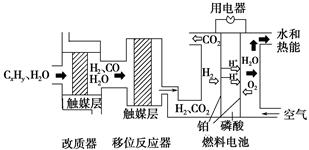
| A.该系统中只存在化学能和电能的相互转化 |
B.在移位反应器中,反应CO(g)+H2O(g) 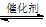 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 |
| C.改质器和移位反应器的作用是将CxHy转化为H2和CO2 |
| D.该电池正极的电极反应为O2+4H++4e-=2H2O |
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z 的 浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) |
| C.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动 |
 2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( ) 
 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是