题目内容
【题目】已知N2(g)+3H2(g)![]() 2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
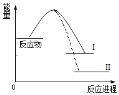
A.1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热
B.N2(g)+3H2(g)![]() 2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
【答案】B
【解析】
A.化学反应的焓变等于旧键断裂吸收的能量和新键生成释放的能量之差,1molN≡N键能与3molHH键能之和小于6molNH键能,所以反应为放热,故A错误;
B.氮气和氢气合成氨的反应是放热反应,反应物和产物的能量差值越大,则反应放出的热量越多,则Q2>Q1,故B正确;
C.催化剂只能改变反应速率,不会引起热效应的改变,选择合适的催化剂,Q1值也不会改变,故C错误;
D.氮气和氢气合成氨的反应是放热反应,反应物的能量大于产物的能量,即2mol氨气的能量低于1mol氮气和3mol氢气的能量之和,故D错误;
答案选B。

【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。