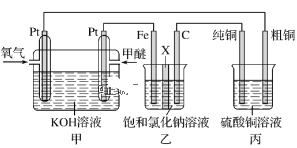
题目内容
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是( )
A.由水电离产生的c(H+)=10-2mol/L
B.加水稀释时![]() 增大
增大
C.与pH=12的NaOH溶液等体积混合后,溶液呈中性
D.与pH=2的盐酸相比,醋酸中H+浓度更大
【答案】B
【解析】
A.由pH=2可知溶液中c(H+)=10-2mol/L,则常温下该溶液中c(OH-)=10-12mol/L,由水电离出的氢氧根和氢离子浓度相同,所以水电离产生的c(H+)=10-12mol/L,大部分氢离子由醋酸电离,故A错误;
B.由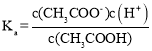 可知
可知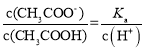 ,加水稀释溶液酸性变弱,氢离子浓度变小,所以
,加水稀释溶液酸性变弱,氢离子浓度变小,所以![]() 增大,故B正确;
增大,故B正确;
C. 氢离子浓度与氢氧根离子浓度相等的醋酸与氢氧化钠,醋酸的物质的量大于氢氧化钠,其等体积混合,醋酸过量,溶液显酸性,故C错误;
D. pH=2的盐酸中c(H+)=10-2mol/L,与醋酸相同,故D错误;
故答案为B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目