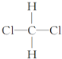��Ŀ����
����Ŀ����1��ij��̼���⡢������Ԫ�ص�δ֪��A����ȼ�շ���֪��̼����������Ϊ60%��������������Ϊ26.7%������ʵ��ʽΪ__��
��2������A�������ͬ״���µ��������ܶ���30����A�Ŀ��ܵĽṹ��__�֣�
��3��A�ĺ������ͼ�Ϸ�����O��H����C��H����C��O���������գ���A�Ľṹ��ʽ����Ϊ���м���д���֣�__��
��4��A�ĺ˴Ź����������������շ壬�����֮��Ϊ1��1��6����A��������__��
���𰸡�C3H8O 3 CH3CH2CH2OH��CH3CH(OH)CH3 2�������������
��������
![]() ̼������������
̼������������![]() ����������������
����������������![]() ����Ԫ������������
����Ԫ������������![]() �����������̼���⡢��ԭ�Ӹ���֮��Ϊ��
�����������̼���⡢��ԭ�Ӹ���֮��Ϊ��![]() ��������ʵ��ʽΪC3H8O���ʴ�Ϊ��C3H8O��
��������ʵ��ʽΪC3H8O���ʴ�Ϊ��C3H8O��![]() A�л�����������ܶ�����ͬ״����������30��������ȷ���л������Է���������60������ʵ��ʽΪC3H8O��֪�������ʽΪC3H8O�����ܵĽṹʽ��
A�л�����������ܶ�����ͬ״����������30��������ȷ���л������Է���������60������ʵ��ʽΪC3H8O��֪�������ʽΪC3H8O�����ܵĽṹʽ��![]() ��
��![]() ��
��![]() ����3�֣��ʴ�Ϊ��3��
����3�֣��ʴ�Ϊ��3��
![]() A�ĺ������ͼ�Ϸ�����O��H����C��H����C��O���������գ���A�Ľṹ��ʽ����Ϊ��
A�ĺ������ͼ�Ϸ�����O��H����C��H����C��O���������գ���A�Ľṹ��ʽ����Ϊ��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ������֪��A�ĺ˴Ź����������������շ壬˵����Ч�������֣������֮����
������֪��A�ĺ˴Ź����������������շ壬˵����Ч�������֣������֮����![]() ��˵����������ĸ���֮��Ϊ
��˵����������ĸ���֮��Ϊ![]() ���ṹΪ
���ṹΪ![]() ��������
��������![]() ��������������ʴ�Ϊ��
��������������ʴ�Ϊ��![]() �������������
�������������

����Ŀ����֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK=[c(CO2)��c(H2)] /[c(CO)��c(H2O)]���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ��ֵ�ֱ�Ϊ��
t/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
����������������
A. �÷�Ӧ�Ļ�ѧ����ʽ�ǣ�CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. �����1L���ܱ������м���CO2��H2��1mol���ٰ��¶����ߵ�830������ʱ���CO2Ϊ0.4 molʱ���÷�Ӧ�ﵽƽ��״̬
D. ��ƽ��Ũ�ȹ�ϵ����c(CO2)/3c(CO)=c(H2O)/5c(H2)�����жϴ�ʱ�¶���1000��