题目内容
【题目】人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减。请回答:
(1)铁原子L能层上有__________种不同运动状态的电子,基态铁原子的外围电子排布式为_____________。
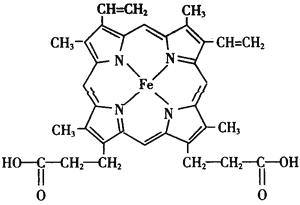
(2)血红素是血液的重要组成部分,其结构如图。其中C原子和N原子具有的相同的杂化方式为________________,N与Fe之间存在的相互作用是___________。血红素在人
体内合成时的基本原料之一是甘氨酸(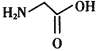 ),其分子中σ键和π键的个数比为___________。
),其分子中σ键和π键的个数比为___________。
(3)单质铁的某种晶体拥有体心立方晶胞,其配位数为___________,若其晶胞边长为a pm,其晶体密度为___________g/cm3(用含a的代数式表示,NA表示阿伏加德罗常数)。
(4)铁氰化钾(K3)俗称赤血盐,可用于检验Fe2+,反应的离子方程式为_____________。其配体的电子式为_______________,与其配体互为等电子体的微粒有_____________(任写两种,填化学式)。
【答案】 8 3d64s2 sp2、sp3 极性键、配位键 9:1 8 ![]() 3Fe2+ +2 3- =Fe32↓
3Fe2+ +2 3- =Fe32↓ ![]() N2、C22-、CO等
N2、C22-、CO等
【解析】(1)铁的电子排布式为1s22s22p63s23p63d64s2,L能层为2s22p6,有8种不同运动状态的电子,基态铁原子的外围电子排布式为3d64s2;
(2)根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;N与Fe之间存在的相互作用是极性键、配位键;甘氨酸(![]() ),其分子中σ键和π键的个数比为9∶1;
),其分子中σ键和π键的个数比为9∶1;
(3)根据晶胞中的配位情况,一个晶胞中含有2个铁,1pm=10-10cm,由ρ=![]() =
=![]() =
=![]() g/cm3;
g/cm3;
(4)铁氰化钾(K3[Fe(CN)6])俗称赤血盐,可用于检验Fe2+,反应的离子方程式为 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;其配体为CN-,它的电子式为![]() ;等电子体为电子数相等,原子数也相等,与其配体互为等电子体的微粒有N2、CO。
;等电子体为电子数相等,原子数也相等,与其配体互为等电子体的微粒有N2、CO。