题目内容
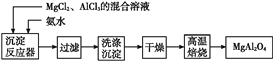
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下:
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为_____________。
(2)判断流程中沉淀是否洗净所用的试剂是__________________。
(3)在25 ℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式:_____________。{已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34}。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
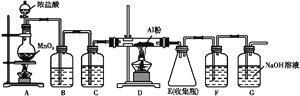
装置B中盛放饱和NaCl溶液,该装置的主要作用是______;F中试剂的作用是__________________________________________。
(5)将Mg、Cu组成的3.92 g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792 L(标准状况),向反应后的溶液中加入4 mol·L-1的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为____g。
【答案】 2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O AgNO3溶液(或硝酸酸化的AgNO3溶液) Al(OH)3 Al3++3NH3·H2OAl(OH)3↓+3NH4+ 除去HCl 吸收水蒸气 8.00
MgAl2O4+4H2O AgNO3溶液(或硝酸酸化的AgNO3溶液) Al(OH)3 Al3++3NH3·H2OAl(OH)3↓+3NH4+ 除去HCl 吸收水蒸气 8.00
【解析】试题分析:由制备MgAl2O4的主要流程可知,MgCl2、AlCl3的混合溶液与过量氨水反应后生成氢氧化镁和氢氧化铝沉淀,沉淀经洗涤、干燥、高温灼烧后得到产品。
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O。
MgAl2O4+4H2O。
(2)沉淀表面可能会吸附少量的氯离子和铵根,判断流程中沉淀是否洗净,可以检验洗涤液中是否有氯离子或铵根,由于氯离子的检验更简单、更灵敏,所以我们经常检验氯离子,所用的试剂是AgNO3溶液(或硝酸酸化的AgNO3溶液)。
(3)根据Ksp[Mg(OH)2]= c(Mg2+)c2(OH)=1.8×10-11,求得 c2(OH)= ![]() ,所以c(OH)=
,所以c(OH)= ![]() mol/L;由 Ksp[Al(OH)3]= c(Al3+) c3(OH)=3×10-34,求得c3(OH)=
mol/L;由 Ksp[Al(OH)3]= c(Al3+) c3(OH)=3×10-34,求得c3(OH)= ![]() ,所以c(OH)=
,所以c(OH)= ![]() 。比较两组数据可知,生成Al(OH)3沉淀所需要的OH浓度更小,所以先生成Al(OH)3沉淀。
。比较两组数据可知,生成Al(OH)3沉淀所需要的OH浓度更小,所以先生成Al(OH)3沉淀。
(4)由题意和装置图可知,该实验先用二氧化锰和浓盐酸反应制备氯气,这样制备的氯气中含有氯化氢和水蒸气,装置B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl,C装置的作用是干燥氯气,D装置是制备氯化铝的装置,E装置收集氯化铝,F装置是保护装置,防止空气中的水蒸气进入E引起氯化铝水解,所以其中试剂的作用是吸收水蒸气,G装置吸收剩余的氯气,防止污染空气。
(5)将Mg、Cu组成的3.92 g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到NO气体1.792 L(标准状况下),则NO的物质的量为0.08mol,反应过程中的电子转移n(e-)=0.08mol![]() =0.24mol,金属离子恰好完全沉淀时生成氢氧化镁和氢氧化铜,沉淀的质量等于金属的质量加上其结合的氢氧根的质量,沉淀中n(OH-)= n(e-)=0.24mol,则形成沉淀的质量为3.92g+0.24mol
=0.24mol,金属离子恰好完全沉淀时生成氢氧化镁和氢氧化铜,沉淀的质量等于金属的质量加上其结合的氢氧根的质量,沉淀中n(OH-)= n(e-)=0.24mol,则形成沉淀的质量为3.92g+0.24mol![]() 17g/mol=8.00g。
17g/mol=8.00g。

 名校课堂系列答案
名校课堂系列答案【题目】将0.2mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀).
A. ①和② B. ②和④ C. ③和④ D. ①