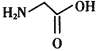
题目内容
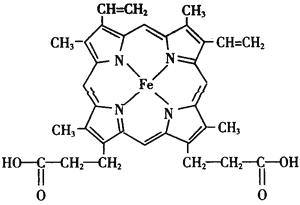
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。
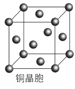
①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
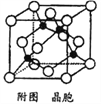
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
【答案】 第四周期第Ⅷ族 分子晶体 5 金属键 Fe2+ sp杂化 N>O>C [Ar]3d104s1 或1s22s22p63s23p63d104s1 12 CuCl 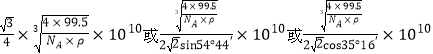
【解析】(1)本题考查元素在周期表的位置,铁位于第四周期VIII族;(2)考查晶体类型的判断、化学键类型,Fe(CO)n常温下呈液态,熔点、沸点较低,易溶于非极性溶剂,这是分子晶体的特点,因此Fe(CO)n属于分子晶体,中心原子为Fe,铁位于VIII族,价电子包括最外层和次外层的d能级,因此价电子数为8,CO有C提供2个孤电子对与铁构成配位键,因此有8+2n=18,即n=5,根据反应方程式,断裂的是配位键,生成物生成了Fe单质,即生成了金属键;(3)本题考查配位化合物、杂化类型、第一电离能规律,K3[Fe(CN)6]检验Fe2+,滴入K3[Fe(CN)6]溶液,出现蓝色沉淀,说明Fe2+的存在,CN-中碳原子与N形成1个σ键,孤电子对数为(4+1-3)/2=1,价层电子对数为2,杂化轨道数等于价层电子对数,即杂化类型为sp,同周期从左向右第一电离能增大,但IIA>IIA、VA>VIA,因此C、N、O的第一电离能的顺序是N>O>C;(4)考查电子排布式的书写和晶胞,铜位于第四周期IB族,因此核外电子排布式是[Ar]3d104s1 或1s22s22p63s23p63d104s1,距离最近的铜原子在面上,每个铜原子周围距离最近的铜原子数目为12(上层4个、同层4个、下层4个);(5)本题考查晶胞的结构,①根据M的外围电子排布式,推出M为Cl,白球位于顶点和面心,因此白球的个数为8×1/8+6×1/2=4,黑球位于体心,有4个,因此化学式为CuCl;②铜原子和Cl原子最近的距离是体对角线的1/4,令晶胞的边长为apm,晶胞的质量为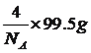 ,晶胞的体积为(a×10-10)3cm3,根据密度的定义推出a=
,晶胞的体积为(a×10-10)3cm3,根据密度的定义推出a=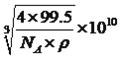 ,即最近的距离为
,即最近的距离为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
【题目】下列除去杂质的方法正确的是( )
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
B | SiO2 | Al2O3 | 氢氧化钠溶液 | 过滤 |
C | Cl2 | HCl | 饱和食盐水 | 洗气 |
D | CO2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A. A B. B C. C D. D