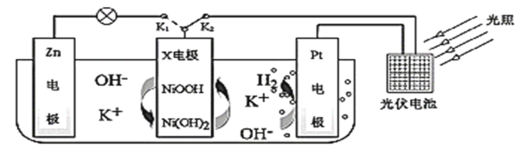
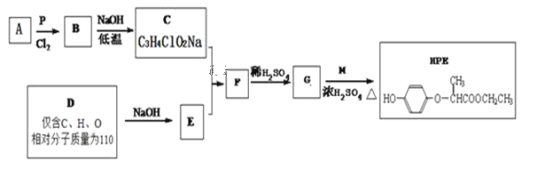
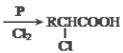
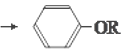
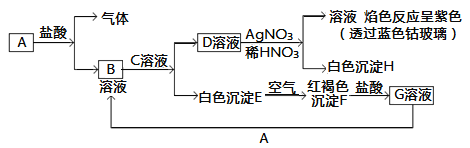
题目内容
【题目】80 ℃时,1 L 密闭容器中充入0.20 mol N2O4,发生反应N2O4(g)2NO2(g) ΔH=Q kJ·mol-1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K增大
B.20~40s内,v(N2O4)=0.004mol·L-1·s-1
C.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大
D.反应达平衡时,吸收的热量为0.15QkJ
【答案】AD
【解析】
A.平衡常数只与温度有关,根据题意△H>0,为吸热反应,升高温度平衡正向移动,则升高温度该反应的平衡常数K增大,故A正确;
B.2040s内,化学反应速率与计量数成正比,则v(N2O4)=![]() v(NO2)=
v(NO2)=![]() ×
×![]() =0.002mol/(Ls),故B错误;
=0.002mol/(Ls),故B错误;
C.100s时再通入0.40molN2O4,可看成起始时体积缩小一半,压强增大,平衡逆向移动,达新平衡时N2O4的转化率减小,故C错误;
D.由表格中信息可知,80s达到平衡,物质的量与热量成正比,则反应达平衡时,吸收的热量为![]() ×QkJ/mol=0.15QkJ,故D正确;
×QkJ/mol=0.15QkJ,故D正确;
答案选AD。

练习册系列答案
相关题目