题目内容
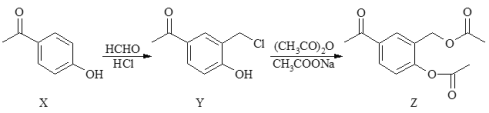
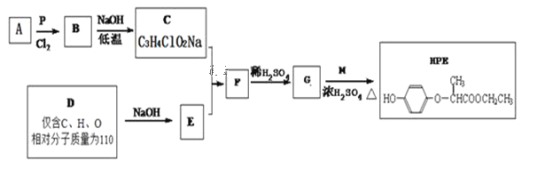
【题目】HPE是合成苯氧基丙酸类除草剂的重要中间体,其合成路线如下:
已知:①RCH2COOH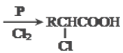
②![]() +RCl
+RCl +NaCl
+NaCl
据此回答下列问题:
(1)B中含有的官能团名称为___,D的结构简式为___。
(2)C + E →F的反应类型为___。
(3)M的核磁共振氢谱中各吸收峰的面积之比为___。
(4)写出G+M→HPE的化学方程式___。
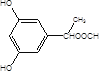
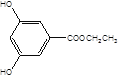
(5)X是G的同分异构体,其中满足以下条件的X共有___种,写出其中的任意三种X的结构简式___。
A.苯环上有3个取代基且苯环上的一氯取代物有两种
B.遇FeCl3溶液发生颜色反应
C.X不能与NaHCO3反应产生CO2
D.1molX最多能和3molNaOH反应
【答案】氯原子、羧基 ![]() 取代反应 3:2:1
取代反应 3:2:1 ![]() +C2H5OH
+C2H5OH![]() +H2O 10
+H2O 10 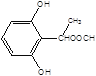 ,
,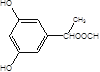 ,
, ,
,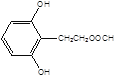 ,
,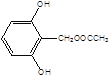 ,
,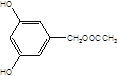 ,
,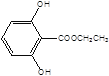 ,
,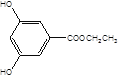 ,
,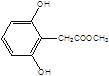 ,
,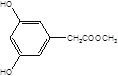
【解析】
根据题中已知①的信息,结合A→B的条件和C的分子式可知,C为CH3CHClCOONa,B为CH3CHClCOOH,A为CH3CH2COOH,根据HPE的结构,结合题中已知信息②和D的分子量为110,且只含C、H、O可知,D为![]() ,则E为
,则E为![]() ,F为
,F为![]() ,所以G为
,所以G为![]() ,G与C2H5OH反应得HPE,所以M为CH3CH2OH。
,G与C2H5OH反应得HPE,所以M为CH3CH2OH。
(1)B为CH3CHClCOOH,含有的官能团名称为氯原子、羧基,D的结构简式为 ![]() ;
;
(2)C + E →F与题中信息②类似,为取代反应;
(3)M为CH3CH2OH,它的核磁共振氢谱中各吸收峰的面积之比为3:2:1;
(4)G+M→HPE的化学方程式 ![]() +C2H5OH
+C2H5OH![]() +H2O;
+H2O;
(5)X是G的同分异构体a.苯环上有3个取代基且苯环上的一氯取代物有两种,b.遇FeCl3溶液发生颜色反应,c.X不能与NaHCO3反应产生CO2,d.1mol X最多能和3mol NaOH反应,其中满足以下条件的X有: 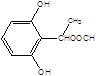 ,
, ,
,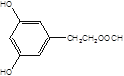 ,
,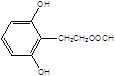 ,
,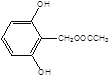 ,
,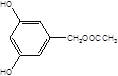 ,
,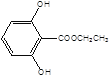 ,
, ,
, ,
,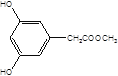 共10种。
共10种。

【题目】80 ℃时,1 L 密闭容器中充入0.20 mol N2O4,发生反应N2O4(g)2NO2(g) ΔH=Q kJ·mol-1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K增大
B.20~40s内,v(N2O4)=0.004mol·L-1·s-1
C.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大
D.反应达平衡时,吸收的热量为0.15QkJ
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%