题目内容
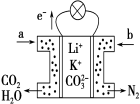
【题目】MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
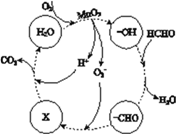
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。
【答案】 SO2 +MnO2 = MnSO4 将Fe2+氧化为Fe3+除去 Fe(OH)3、Al(OH)3 Pb2+、Ca2+ Mn2+ + 2H2O![]() MnO2 + H2↑ + 2H+ HCO3- HCHO + O2
MnO2 + H2↑ + 2H+ HCO3- HCHO + O2![]() CO2 + H2O
CO2 + H2O
【解析】软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)通入SO2浸出液的pH<2,MnO2与SO2发生氧化还原反应,其中的金属离子主要是Mn2+,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰乳,杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,调节pH值4.7,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,加入阳离子吸附剂,除去Ca2+、Pb2+,过滤,滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
(1)I中向软锰矿浆中通入SO2生成MnSO4,MnO2与SO2发生氧化还原反应的化学方程式为SO2+MnO2=MnSO4;故答案为:SO2+MnO2=MnSO4;
(2)杂质离子中Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,加入石灰乳,调节pH值4.7,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,故生成的沉淀主要为Fe(OH)3、Al(OH)3和少量CaSO4;故答案为:将Fe2+氧化为Fe3+;Fe(OH)3、Al(OH)3;
(3)由题可知通过步骤III得到的溶液为含有锰离子的溶液,此步骤中需要对剩余的金属离子进行了除杂,可以加入阳离子吸附剂,除去Ca2+、Pb2+;故答案为:Ca2+、Pb2+;
(4)①用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,总反应离子方程式为:Mn2++2H2O![]() MnO2+H2↑+2H+;故答案为:Mn2++2H2O
MnO2+H2↑+2H+;故答案为:Mn2++2H2O![]() MnO2+H2↑+2H+;
MnO2+H2↑+2H+;
②氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水,该反应的总反应方程式为:HCHO+O2![]() CO2+H2O,故答案为:HCO3-;HCHO+O2
CO2+H2O,故答案为:HCO3-;HCHO+O2![]() CO2+H2O。
CO2+H2O。

【题目】温度会影响微生物的生存和繁殖.下表为大肠杆菌在不同温度下繁殖l代所用的时间(min).根据表格可直接得出哪项结论( )
温度 | 10℃ | 15℃ | 20℃ | 25℃ | 30℃ | 35℃ | 40℃ | 45℃ | 50℃ | ||
时间 | 860 | 120 | 90 | 40 | 29 | 22 | 1 | 5 | 2 | 0 | 80 |
A.10℃时细菌繁殖最快 B.温度越高酶活性越强
C.低温可抑制细菌繁殖 D.酶的活性受时间控制
【题目】某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究。
实验编号 | 反 应 物 | 催 化 剂 |
甲 | 试管中加入3 mL 2﹪ H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol/L FeCl3溶液 |
丁 | 试管中加入3 mL 5﹪ H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
戊 | 试管中加入3 mL 5﹪ H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5﹪的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生。
(1)上述实验发生反应的化学方程式为 。
(2)实验甲和实验乙的实验目的是 ;
实验丙、实验丁和实验戊的实验目的是 。
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的? 。
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验戊,0~20 s的反应速率v1= mL/s,100~120 s的反应速率v2= mL/s。
不考虑实验测量误差,二者速率存在差异的主要原因是 。
②如右图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 (填“丙”、“丁”或“戊”)。