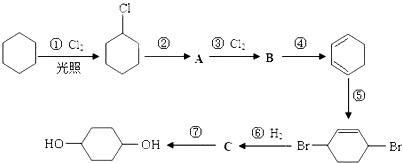
��Ŀ����
����Ŀ��25 ��ʱ���ϳɰ���Ӧ���Ȼ�ѧ����ʽΪ��N2 (g) +3H2 (g)![]() 2NH3(g) ��H����92.4 kJ/mol
2NH3(g) ��H����92.4 kJ/mol
����������ȷ����
A. ����������������ʱ��˵���÷�Ӧһ���ﵽƽ��״̬
B. ���������������ԭ���Ķ�������(��)��С����(��)����ƽ�������ƶ�
C. �����������N2��ת���ʣ��������̴ﵽƽ������ʱ�䣬�������Ч��
D. ���ܱ������з���1 mol N2��3 mol H2���з�Ӧ����÷�Ӧ�ų�������С��92.4 kJ
���𰸡�D
��������A�������Ƿ�Ӧ�ﻹ��������������壬����˵�������Ƿ�ﵽƽ�⣬�����������������䡣
B�����������������ԭ���Ķ�������Ӧ�������Ũ�Ⱦ���С�������(��)����(��)����С��ƽ�������ƶ�
C�������Ȳ������N2��ת����,�������̴ﵽƽ������ʱ�䣬�������Ч��
D�����ڴ˷�Ӧʱ���淴Ӧ�����ܱ������з���1 mol N2��3 mol H2���з�Ӧ����÷�Ӧ�ų�������С��92.4 kJ

����Ŀ��MnSO4�ڹ�ҵ������ҪӦ�á������̿���Ҫ�ɷ�ΪMnO2��ˮ������Fe2O3��FeO��Al2O3������PbO�����ʣ������Ʊ�MnSO4����������£�
I�������̿���ͨ��SO2���̡���������ǦԪ����������ʽ��������ý���Һ��pH��2��
II�������Һ�м�MnO2����ַ�Ӧ����ʯ���飬����ҺpH = 4.7��
III���ټ��������������������ú���ˡ�
IV����Һ����Ũ������ȴ�ᾧ�����MnSO4���塣
�����ϡ������������γ��������������pH
���� | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
��ʼ����ʱ��pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
��ȫ����ʱ��pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
��1��I�������̿���ͨ��SO2����MnSO4���÷�Ӧ�Ļ�ѧ����ʽ��________��
��2��II�м���MnO2����ҪĿ����________������Һ pH=4.7�����ɵij�����Ҫ����________������CaSO4��
��3��III�м�������������������Ҫ��ȥ��������________��
��4���ö��Ե缫���MnSO4��Һ�������Ƶø���MnO2��
�����MnSO4��Һ�����ӷ���ʽ��________��
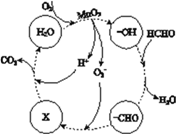
������MnO2�����ڴ������ȩ���й����ı仯����ͼ��ʾ������X��________���ܷ�Ӧ�Ļ�ѧ����ʽ��________��