题目内容
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)![]() H2O(l) ΔH=285.8 kJ·mol1
H2O(l) ΔH=285.8 kJ·mol1
②H2(g)+1/2O2(g)![]() H2O(g) ΔH=241.8 kJ·mol1
H2O(g) ΔH=241.8 kJ·mol1
③C(s)+ 1/2O2(g)![]() CO(g) ΔH=110.5 kJ·mol1
CO(g) ΔH=110.5 kJ·mol1
④C(s)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1
CO2(g) ΔH=393.5 kJ·mol1
回答下列各问题:
(1)上述反应中属于放热反应的是_______________________。
(2)H2的燃烧热为________
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
【答案】①②③④ 285.8kJmol-1 1429.0 kJ 283.0 kJ/mol CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
【解析】
(1)放热反应的焓变小于0;
(2) 根据燃烧热的概念;
(3) 根据2gH2燃烧生成液态水放出285.8kJ的热量计算;
(4)观察题给方程式,不难看出,题目要求写出的方程式可据盖斯定律,④-③得:CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol。
O2(g)=CO2(g) △H=-283.0kJ/mol。
(1)已知四个热化学方程式的焓变都小于0,故都是放热反应,
故答案为:①②③④;
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,所以H2的燃烧热为285.8kJmol-1;
故答案为:285.8kJmol-1;
(3)2gH2燃烧生成液态水放出285.8kJ ,则燃烧10 g H2生成液态水Q放=![]() ×285.8 kJ=1 429.0 kJ。
×285.8 kJ=1 429.0 kJ。
故答案为:1429.0 kJ;
(4)据盖斯定律,④-③得:CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol,故CO的燃烧热为283.0 kJ/mol,
O2(g)=CO2(g) △H=-283.0kJ/mol,故CO的燃烧热为283.0 kJ/mol,
故答案为:283.0 kJ/mol;CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol。
O2(g)=CO2(g) △H=-283.0kJ/mol。

【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
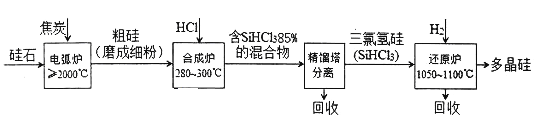
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
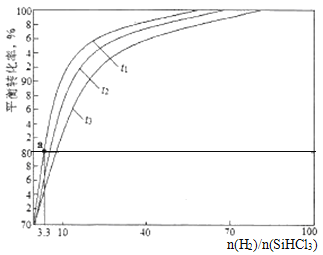
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。