题目内容
(12分)原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36。已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
(1)X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于Z的原因是 。
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
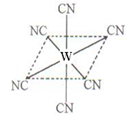
①W元素基态原子价电子排布式为 。
②已知CN—与 分子互为等电子体,1molCN—中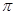 键数目为 。
键数目为 。
③上述沉淀溶解过程的化学方程式为 。
| 电离能/kJ·mol—1 | I1 | I2 | I3[来源:] | I4[来源: |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。

①W元素基态原子价电子排布式为 。
②已知CN—与 分子互为等电子体,1molCN—中
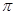 键数目为 。
键数目为 。③上述沉淀溶解过程的化学方程式为 。
(1)Al>Mg>Na;Y原子的最外层电子排布处于全满,依据洪特规则特例为较为稳定结构。(每空2分)
(2)①3d64s2 ② N2, 2mol(或2NA或2x6.02x1023)
③Fe(CN)2 + 4KCN=K4[Fe(CN)6](每空2分)
(2)①3d64s2 ② N2, 2mol(或2NA或2x6.02x1023)
③Fe(CN)2 + 4KCN=K4[Fe(CN)6](每空2分)
(1)根据得失电子规律,同一主族从上到下电离能依次递减,同一周期从左到右电离能依次递增。因为X、Y和Z为第三周期元素素,所以根据元素的电离能可知,X是Na,Y是Mg,Z是Al。因此X、Y、Z的电负性从大到小的顺序为Al>Mg>Na。镁原子的最外层电子排布处于全满,稳定性强,所以第一电离能大于Al的。
(2)人体内W元素的含量偏低,则会影响O2在体内的正常运输,所以W是Fe。
①根据构造原理可知,铁元素基态原子价电子排布式为3d64s2。
②原子数和电子数都相等的分子是等电子体,所以和CN—互为等电子体的是氮气。CN—中含有三键,所以1molCN—中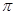 键为2mol。
键为2mol。
③根据配离子结构图可知,反应的方程式为Fe(CN)2 + 4KCN=K4[Fe(CN)6]。
(2)人体内W元素的含量偏低,则会影响O2在体内的正常运输,所以W是Fe。
①根据构造原理可知,铁元素基态原子价电子排布式为3d64s2。
②原子数和电子数都相等的分子是等电子体,所以和CN—互为等电子体的是氮气。CN—中含有三键,所以1molCN—中
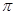 键为2mol。
键为2mol。③根据配离子结构图可知,反应的方程式为Fe(CN)2 + 4KCN=K4[Fe(CN)6]。

练习册系列答案
相关题目