题目内容
【题目】某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:

探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略) 。
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________。
(2)装置 D的作用是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管B 中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管 B 冷却后,取少许其中的固体物质继续进行如下实验:
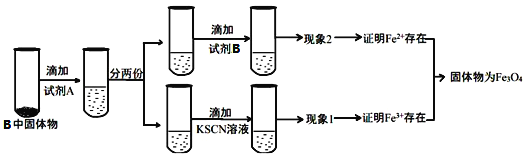
①试剂A是________,现象2为___________________ 。
②若现象1中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:________________________________________________________________________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如下:
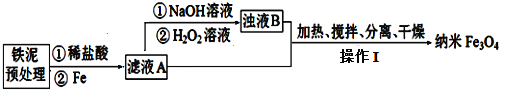
已知:①浊液B中铁元素以FeOOH形式存在;
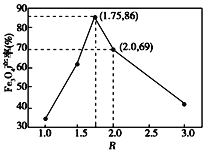
②在操作I中,相同条件下测得Fe3O4的产率与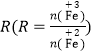 的关系如下图所示。
的关系如下图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是_________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,保留3位有效数字)
=_________。(填数值,保留3位有效数字)
【答案】3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 除去H2中的水蒸气,防止E的玻璃管破裂 稀硫酸 酸性KMnO4溶液褪色 B中固体可能有Fe3O4 和Fe,Fe将Fe3+全部还原为Fe2+ 加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素 63.6%
Fe3O4 + 4H2 除去H2中的水蒸气,防止E的玻璃管破裂 稀硫酸 酸性KMnO4溶液褪色 B中固体可能有Fe3O4 和Fe,Fe将Fe3+全部还原为Fe2+ 加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素 63.6%
【解析】
探究一:A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气;
(2) 装置 D有除去H2中的水蒸气,防止E的玻璃管破裂的作用。
探究二:(3)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应;
亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化。
探究三:B中固体(主要成分为Fe3O4和少量Fe)与稀盐酸反应得到的滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-![]() Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答。
Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答。
探究一、A中制取水蒸气、B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe + 4H2O(g) ![]() Fe3O4 + 4H2,
Fe3O4 + 4H2,
因此,本题正确答案是:3Fe + 4H2O(g) ![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
(2) 装置 D有除去H2中的水蒸气,防止E的玻璃管破裂的作用,
因此,本题正确答案是:除去H2中的水蒸气,防止E的玻璃管破裂。
探究二:(3)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应,向溶液中加入KSCN溶液呈红色,说明含有四氧化三铁,可能含有Fe;铁离子和Fe反应生成亚铁离子,不变红色说明固体中含有四氧化三铁和Fe,
①根据实验流程试剂A应是稀硫酸,亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液检验亚铁离子,现象2为酸性KMnO4溶液褪色,
因此,本题正确答案是:稀硫酸;酸性KMnO4溶液褪色;
②若现象1中溶液未变血红色,说明B中固体可能有Fe3O4 和Fe,Fe将Fe3+全部还原为Fe2+,
因此,本题正确答案是:B中固体可能有Fe3O4 和Fe,Fe将Fe3+全部还原为Fe2+;
探究三:(4)步骤④中,浊液D中的氢氧化亚铁与过氧化氢反应生成FeOOH,反应为:2Fe(OH)2+H2O2=2FeOOH+2H2O;步骤④中,防止其在步骤⑤中继续氧化+2价铁元素,反应完成后需再加热一段时间除去剩余H2O2;
因此,本题正确答案是:加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素;
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。
则滤液A中与FeOOH反应的亚铁离子物质的量为(b-a)mol,由图可知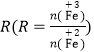 =1.75时,Fe3O4的产率最高,则
=1.75时,Fe3O4的产率最高,则![]() =1.75,解得:
=1.75,解得:![]() =0.636;
=0.636;
因此,本题正确答案是:0.636。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。


