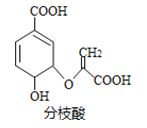
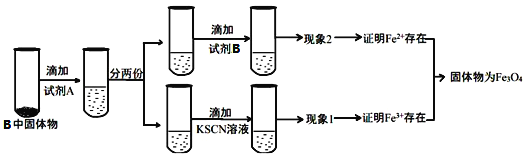
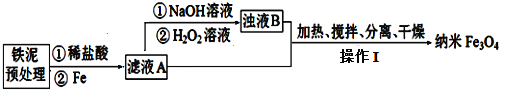
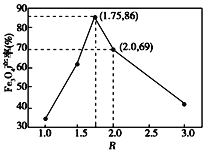
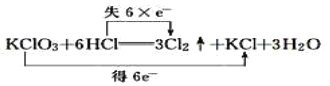
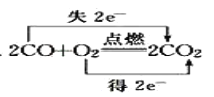
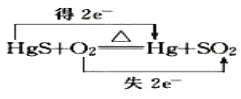
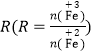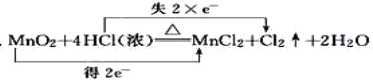题目内容
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(提示:SiO2为难溶于盐酸的固体)

请回答下列问题:
(1)固体a的化学式为________。
(2)在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、_________________;Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(3)由Ⅲ中得到滤液c的实验操作为_____________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_________________________。
(4)0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合的离子反应方程式为_____________________________________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和加入的H2SO4的物质的量之比为________。
【答案】SiO2 Al3+ + 4OH-= AlO2-+2H2O AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 过滤 蒸发浓缩、冷却结晶、过滤洗涤 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 3∶10
【解析】
(1)Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸;
(2)Ⅱ中加过量的烧碱,铝离子和过量碱反应生成偏铝酸钠和水;碳酸的酸性强于偏铝酸,故二氧化碳与偏铝酸钠生成氢氧化铝沉淀;
(3)由Ⅲ中得到滤液c的实验操作为过滤;依据从可溶性溶液中获取固体的实验方法回答;
(4)设NH4Al(SO4)2为2mol,则Ba(OH)2为3mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,恰好需要3mol Ba(OH)2,此时发生2 NH4Al(SO4)2+3 Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓;
(5)设制得的Al2(SO4)3和NH4Al(SO4)2![]() 12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可。
12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可。
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2;
故答案为:SiO2;
(2)Al2O3和Fe2O3溶于过量盐酸生成AlCl3、FeCl3,因此在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、Al3+ + 4OH-= AlO2-+2H2O;Ⅲ中通入足量CO2气体生成Al(OH)3沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓。
故答案为:Al3+ + 4OH-= AlO2-+2H2O ;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(3)由Ⅲ中得到滤液c的实验操作为过滤;从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤。
故答案为:过滤;蒸发浓缩、冷却结晶、过滤洗涤;
(4)设NH4Al(SO4)2为2mol,则Ba(OH)2为3mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,恰好需要3mol Ba(OH)2,此时发生2 NH4Al(SO4)2+3 Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓,离子方程式为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓。
故答案为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓。
(5)设制得的Al2(SO4)3和NH4Al(SO4)2![]() 12H2O的物质的量都是1mol,则对应的Al3+共3mol,SO42-共5mol,根据Al3+和SO42-守恒可知加入Al2O3和H2SO4的物质的量之比为
12H2O的物质的量都是1mol,则对应的Al3+共3mol,SO42-共5mol,根据Al3+和SO42-守恒可知加入Al2O3和H2SO4的物质的量之比为![]() :5=3:10。
:5=3:10。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案