��Ŀ����
����Ŀ����°����ҹ������Ĺ�ҵ��ѧ�ң�����һ��ΰ��İ����ߣ������������ƼΪ�й���ѧ��ҵ�������绯ѧ��ҵ��������Ҫ�Ĺ��ף�����Ϊ�������Ƽ��������ش��������⣺
��1��ijͬѧΪ����֤NaHCO3��Na2CO3���ȶ��ԣ��������ͼ��ʵ��װ��(����̨���г�����������װ�õ���ʡ��)��
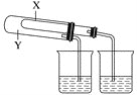
����Ϊ��X��Ӧ�ŵ�������__(�ѧʽ)��
��2��ij��ѧ�о���ѧϰС������ʦ��ָ���£�ģ���°������Ƽ�ԭ���������ͼ��ʵ��װ�á�
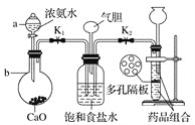
��д���й����������ƣ�a__��b__��
��ʵ��IJ��������У�����Ϊ������K1��K2�ĺ���˳��ӦΪ�ȴ�__�����__(����ĸ����)����������___��
����ʢ����ʳ��ˮ��װ���з�����Ӧ�����ӷ���ʽΪ__��װ����������������__��
���𰸡�NaHCO3 ��Һ©�� Բ����ƿ K1 K2 ������ˮ���ܽ�Ⱥܴ�(1��700)����ͨ�����������ڶ�����̼�ij�����գ�������Ƽ��Ч�� Na����NH3��CO2��H2O=NaHCO3����NH4+ ƽ��װ������ѹǿ���洢ʣ������
��������
�����Ƽ�����������Ȼ�����Һ��ͨ�백������ͨ��CO2����̼�����Ƶ��ܽ�ȱ�̼����С����̼�����Ƴ������ɣ�������ϴ�Ӹ�����ٽ�̼�����Ƽ��ȷֽ�ɵô��ͬʱ���ɵ�CO2ѭ�����á�
��1��̼���Ʊ�̼�������ȶ�����ѡ���Ӽ��ȵķ������Ƚ������ε��ȶ��ԣ�
��2���ٸ���ʵ��װ���ж��������ƣ�
�ں����Ƽ��ԭ������ͨ��������ͨCO2�����ð�������ˮ�γɼ�����Һ����������CO2���ܽ⣻
�۱���ʳ��ˮ����ͨ��������ͨCO2���������ܽ�ȸ�С��̼�����ƣ���Ӧ����ʽΪNaCl��NH3��CO2��H2O=NaHCO3����NH4Cl���ݴ˻ش����⡣
��1��Y��ֱ�Ӽ��ȵĹ��壬��ѡ��̼���ƣ�X�Ǽ�Ӽ��ȵĹ��壬Ϊ̼�����ƣ�����ʵ��ʱֱ�Ӽ��ȵ�̼���Ʋ��ֽ⣬��Ӽ��ȵ�̼�����Ʒ����ֽ⣬��֪̼���Ʊ�̼�������ȶ���
��2����aΪ��Һ©����bΪԲ����ƿ��
�ں����Ƽ��ԭ������ͨ��������ͨCO2������Ӧ�ȴ�K1���ٴ�K2��ԭ���ǰ�������ˮ�γɼ�����Һ����������CO2���ܽ⣬������Ƽ��Ч�ʣ�
�۱���ʳ��ˮ����ͨ��������ͨCO2���������ܽ�ȸ�С��̼�����ƣ���Ӧ����ʽΪNaCl��NH3��CO2��H2O=NaHCO3����NH4Cl�����ӷ���ʽΪNa����NH3��CO2��H2O=NaHCO3����NH4+��װ����������������ƽ������ѹǿ���洢ʣ�����塣

����Ŀ������ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ�������ȡ���ֻ����Լ�������Ϊ�����ܾ�����Ȼ��ܾ�����Ʊ����̣��ش��������⣺
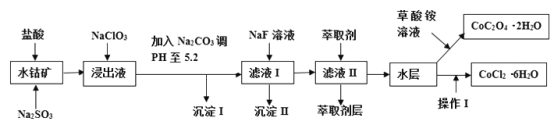
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+��Mg2+��Ca2+�ȣ��ڳ���I��ֻ�������ֳ������������в���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1������������Co2O3������Ӧ�����ӷ�Ӧ����ʽΪ_________________��
��2��NaClO3�ڽ���Һ�з��������ӷ�Ӧ����ʽΪ______________��
��3������Na2CO3��PH��5.2��Ŀ����________����ȡ���㺬��Ԫ�أ������II����Ҫ�ɷ�Ϊ_____��
��4������I��������ˮ�����Ũ�������PHΪ2-3��______��_____�����ˡ�ϴ�ӡ���ѹ��ɵȹ��̡�
��5��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ���������������ữ����������Һ�����ˡ�ϴ�ӡ���������������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O������������100%,��ԭ�������_____���ش�һ��ԭ�ɣ���