题目内容
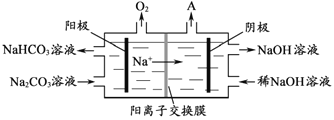
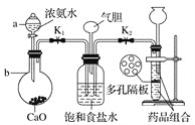
【题目】某工厂采用电解法处理含铬废水,利用耐酸电解槽阴阳极,槽中盛放含铬废水,原理示意如图,下列说法不正确的是( )

A.a为电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O72—+6Fe2++14H+==2Cr3++6Fe3++7H2O
C.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2 molCr2O72—被还原
D.阴极区附近溶液pH增大
【答案】C
【解析】
A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故a为电源正极,A项正确;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,B项正确;
C.13.44L氢气的物质的量为![]() =0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据电子转移守恒n(Fe2+)=![]() =0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×![]() =0.1mol,C项错误;
=0.1mol,C项错误;
D. 阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,D项正确;
答案选C。

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目