题目内容
【题目】Ⅰ.高铁酸盐在能源,环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
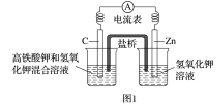
(1)该电池放电时正极的电极反应式为_________________;若维持电流强度为lA,电池工作10 min,理论消耗Zn______g(己知F=965OOC/mol,计算结果小数点后保留一位数字)。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”,下同)池移动;若用阳离子交换膜代替盐桥,则钾离子向______移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线.由此可得出高铁电地的优点有______________。

Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力.降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(4)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。
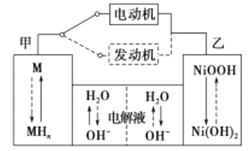
(5)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:
H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______腐蚀。利用如图装置,可以模拟铁的电化学防护。
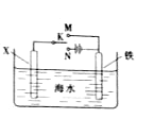
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
【答案】FeO42-+4H2O+3e-=Fe(OH)3+5OH- 0.2 右 左 使用时间长、工作电压稳定 C8H18(l) + ![]() O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol 增大 NiOOH+H2O+e-=Ni(OH)2+OH- 吸氧 N 牺牲阳极的阴极保护法。
O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol 增大 NiOOH+H2O+e-=Ni(OH)2+OH- 吸氧 N 牺牲阳极的阴极保护法。
【解析】
(1)根据电池装置,Zn做负极,C为正极;根据电子转移计算Zn的质量;
(2)原电池中,阳离子向正极移动,阴离子向负极移动;
(4)注意燃烧热指1mol可燃物完全燃烧生成稳定的氧化物(如液态水);
(5)混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理;
(6)紧扣牺牲阳极的保护法和外加电流的阴极保护法原理答题即可。
(1)C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若维持电流强度为1A,电池工作十分钟,通过电子为![]() ,则理论消耗Zn为
,则理论消耗Zn为![]() ×
×![]() ×65g/mol=0.2g;
×65g/mol=0.2g;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用阳离子交换膜代替盐桥,阳离子向正极移动,则钾离子向左移动;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定;
(4)辛烷燃烧生成1mol水蒸气放热550kJ,所以生成9mol水蒸气放热4950kJ,1 g水蒸气(即![]() mol)转化为液态水放热2.5kJ,9mol水蒸气转化为液态水放热405kJ,综上,辛烷的燃烧热为5355kJ/mol。则辛烷燃烧热的热化学方程式为C8H18(l) +
mol)转化为液态水放热2.5kJ,9mol水蒸气转化为液态水放热405kJ,综上,辛烷的燃烧热为5355kJ/mol。则辛烷燃烧热的热化学方程式为C8H18(l) + ![]() O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol;
O2(g)=8CO2(g)+9H2O(l) △H=-5355kJ/mol;
(5)H2+2NiOOH![]() 2Ni(OH)2,混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理,乙电极是正极,是NiOOH转化为氢氧化镍的过程,该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故碱性增强,乙电极周围溶液的pH增大;
2Ni(OH)2,混合动力车上坡或加速时,电池处于放电状态即原电池的工作原理,乙电极是正极,是NiOOH转化为氢氧化镍的过程,该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故碱性增强,乙电极周围溶液的pH增大;
(6)水膜呈中性或者酸性较弱时发生吸氧腐蚀,海水中发生的是吸氧腐蚀。在电解池中,阴极是被保护的电极,可以把船体与电源的负极相连,作阴极被保护,则若X为碳棒,为减缓铁的腐蚀,开关K应置于N处。在原电池中,活泼性较差的电极一般为正极,正极被保护,若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法。