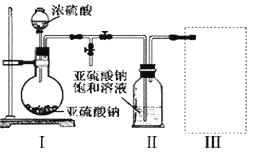
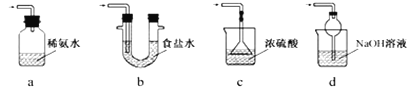
题目内容
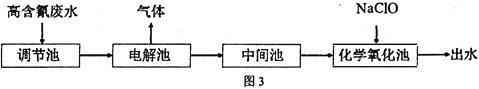
【题目】“五水共治”是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰![]() 废水处理方案:
废水处理方案:
![]() 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:![]() ,请写出第二阶段的电极反应式________。
,请写出第二阶段的电极反应式________。
![]() 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将![]() 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
【答案】![]() 或
或![]()
![]()
【解析】
根据流程:电解高含氰(CN-)废水得到氮气等无污染的气体,电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气;
(1)高含氰废水可以通过电解法进行处理,第一阶段电极反应式:CN-+2OH--2e-=CNO-+H2O,第二阶段为CNO-继续失去电子生成无污染的氮气和二氧化碳气体,据此书写;
(2)电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气,ClO-自身被还原为Cl-,据此书写。
(1)第一阶段电极反应式:CN-+2OH--2e-=CNO-+H2O,第二阶段为CNO-继续失去电子生成无污染的氮气和二氧化碳气体,电极反应式为:2CNO-+4OH--6e-=2CO2↑+N2↑+2H2O(或2CNO-+8OH--6e-=2CO32-+N2↑+4H2O);
(2)电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气,ClO-自身被还原为Cl-,反应为:5ClO-+2OH-+2CN-=2CO32-+N2↑+H2O+5Cl-。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
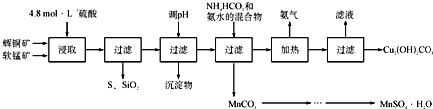
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
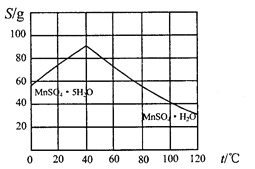
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。