题目内容
【题目】氮及其化合物与人类生产、生活密切相关。
⑴氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g) + NO2 (g) =NO(g) +CO2(g) ΔH= -a kJ·mol-1(a > 0)
2CO(g) + 2NO(g) =N2(g) + 2CO2(g) ΔH = -b kJ·mol-1(b > 0)
若用CO还原NO2至N2,当消耗标准状况下3.36 L CO时,放出的热量为______ kJ(用含有a和b的代数式表示)。
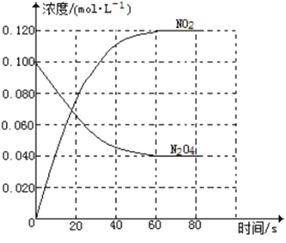
⑵在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH = -57.0 kJ·mol-1测得NO2的体积分数φ(NO2)与反应时间(t)的关系如表:
N2O4(g) ΔH = -57.0 kJ·mol-1测得NO2的体积分数φ(NO2)与反应时间(t)的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
NO2 | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0—20min内,υ(N2O4)= ______molL-1min-1。
②上述反应中,υ(NO2)=k1c2(NO2),υ(N2O4)=k2c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为______。改变温度至T1时k1 = k2,则T1______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
⑶连二次硝酸(H2N2O2)是一种二元弱酸。25C时,向100mL 0.10 molL-1 H2N2O2溶液中加入V mL 0.10 molL-1 NaOH溶液。(已知25C时,连二次硝酸的Ka1 = 10-7,Ka2 = 10-12)
①若V =100,则所得溶液中c(H2N2O2) ______c(N2O22-)(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”),通过计算解释原因______。
”),通过计算解释原因______。
②若V =200,则所得溶液中离子浓度由大到小的顺序为______。
【答案】![]() 2×10-3
2×10-3 ![]() > > 恰好完全反应生成NaHN2O2,
> > 恰好完全反应生成NaHN2O2,![]() ,水解程度大于电离程度 c(Na+) >c(N2O22-) > c(OH-) > c(HN2O2-) > c(H+)
,水解程度大于电离程度 c(Na+) >c(N2O22-) > c(OH-) > c(HN2O2-) > c(H+)
【解析】
⑴根据盖斯定律和反应热来计算放出热量。
⑵①根据三段式建立关系,再进行计算;②根据υ(正)=υ(逆),即υ(NO2)=2υ(N2O4),达到平衡时,根据体积分数求算每个物质的量,再求平衡常数得出结论。
⑶①根据产物NaHN2O2,HN2O2-的水解平衡常数与电离程度比较得出结论;②根据产物Na2N2O2,水解使溶液呈碱性,同时还需考虑水的电离得出结论。
⑴CO还原NO2至N2的化学方程式为:4CO + 2NO2 = N2 +4CO2,
已知:CO(g) + NO2 (g) =NO(g) +CO2(g) ΔH1= -a kJ·mol-1,
2CO(g) + 2NO(g) =N2(g) + 2CO2(g) ΔH2 = -b kJ·mol-1,
反应4CO + 2NO2 = N2 +4CO2可由第一个方程乘以2加上第二个方程得到,根据盖斯定律,该反应的焓变为ΔH= 2ΔH1 + ΔH2= (-2a-b) kJ·mol-1,当消耗标准状况下3.36 L CO时,即消耗CO的物质的量为0.15 mol,所以放出的热量为![]() ,故答案为:
,故答案为:![]() 。
。
⑵① 2NO2(g)![]() N2O4(g)
N2O4(g)
开始: 0.4 0
转化: 2x x
后来:0.4-2x x
20min时,NO2的体积分数为0.75,所以![]() ,可得x =0.08,所以反应20min时,生成N2O4的物质的量为0.08mol,0—20min内,用N2O4的表示的反应速率为
,可得x =0.08,所以反应20min时,生成N2O4的物质的量为0.08mol,0—20min内,用N2O4的表示的反应速率为![]() ,故答案为:2×10-3。
,故答案为:2×10-3。
②反应达到平衡时有υ(正)=υ(逆),即υ(NO2)=2υ(N2O4),达到平衡时,NO2的体积分数为0.40,即![]() ,可得x =0.15,所以化学平衡常数为
,可得x =0.15,所以化学平衡常数为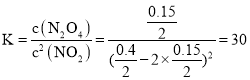 ,则有k1c2(NO2) = 2k2c(N2O4),所以
,则有k1c2(NO2) = 2k2c(N2O4),所以 ,改变温度至T1时k1 = k2,由于k1 = 2k2K,则
,改变温度至T1时k1 = k2,由于k1 = 2k2K,则![]() ,平衡常数减小,考虑到反应为放热反应,温度升高,不利于反应正向进行,所以温度应为升高,即T1 > 373K,故答案为:
,平衡常数减小,考虑到反应为放热反应,温度升高,不利于反应正向进行,所以温度应为升高,即T1 > 373K,故答案为:![]() ;>。
;>。
⑶①若V =100,则反应恰好生成NaHN2O2,HN2O2-的水解平衡常数为![]() ,所以水解程度大于电离程度,溶液中c(H2N2O2) > c(N2O22-),故答案为:>;恰好完全反应生成NaHN2O2,
,所以水解程度大于电离程度,溶液中c(H2N2O2) > c(N2O22-),故答案为:>;恰好完全反应生成NaHN2O2,![]() ,水解程度大于电离程度。
,水解程度大于电离程度。
②若V =200,反应恰好生成Na2N2O2,水解使溶液呈碱性,同时还需考虑水的电离,即溶液中c(N2O22-) > c(OH-),所以溶液中离子浓度大小顺序为:c(Na+) >c(N2O22-) > c(OH-) > c(HN2O2-) > c(H+),故答案为:c(Na+) >c(N2O22-) > c(OH-) > c(HN2O2-) > c(H+)。

【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X在元素周期表中的位置为:___,它的一种核素可测定文物年代,这种核素的符号是___。
(2)元素Y的原子结构示意图为___,Y与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法__。
(3)元素Z与元素T相比,非金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)X的最高价氧化物的结构式为__。
【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。


(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。