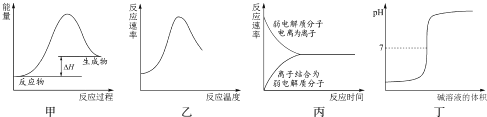
题目内容
【题目】某同学利用如图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质. 请回答下列问题: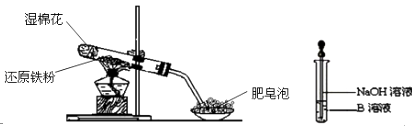
(1)装置中湿棉花的作用 . 硬质试管中发生反应的化学方程式为 .
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案: ①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 .
若溶液未变红色,则说明硬质试管中固体物质的成分是 .
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是: . (用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变成红褐色沉淀所发生发应的化学方程式: .
【答案】
(1)提供水蒸气;3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(2)一定有Fe3O4,可能有Fe; Fe3O4和Fe
(3)Fe+2Fe3+=3Fe2+
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】解:(1)铁与水蒸气高温下反应生成四氧化三铁和氢气,装置中湿棉花的作用提供水蒸气,反应方程式:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
所以答案是:提供水蒸气; 3Fe+4H2O(g) ![]() Fe3O4+4H2;(2)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
Fe3O4+4H2;(2)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
所以答案是:一定有Fe3O4,可能有Fe;Fe3O4和Fe;(3)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,
所以答案是:Fe+2Fe3+=3Fe2+;(4)白色沉淀为氢氧化亚铁,氢氧化亚铁具有还原性,易被空气中氧气氧化生成氢氧化铁,反应的方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】A,B,C,D是元素周期表中的短周期元素,且原子序数依次增大.A元素原子中无中子,B元素的一种同位素常用于文物考古,且该元素形成的化合物种类最多,D元素的原子核外最外层电子数是次外层电子数的三倍.回答下列问题:
(1)D元素的符号是 , C元素组成的单质C2的电子式是 .
(2)2016年10月17日7:30分在甘肃的酒泉卫星发射基地,我国成功发射“神舟十一号”载人飞船.火箭的发动机燃料更新为液态偏二甲肼(分子式为C2H8N2),氧化剂为液态的C2D4 , 燃烧后产物对环境无污染.写出偏二甲肼与C2D4反应的化学方程式:
(3)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:
①C2(g)+2D2(g)═C2D4(L)△H1═﹣19.5kJ/mol
②C2A4(L)+D2(g)═C2(g)+2A2D(g)△H2═﹣534.2kJ/mol
写出液体燃料C2A4与液态C2D4反应的热化学方程式: .
(4)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图: 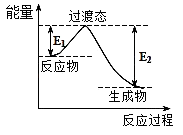
已知破坏1mol不同共价键的能量(kJ)分别是:
B﹣A | B﹣D | B=D | A﹣A | A﹣D |
413.4 | 351 | 745 | 436 | 462.8 |
①写出BD2和A2转化为1mol BA3DA(g)和A2D(g)的热化学方程式:
②已知E1=8.2kJmol﹣1 , 则E2=kJmol﹣1 .