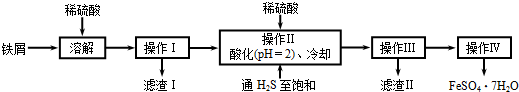
题目内容
4.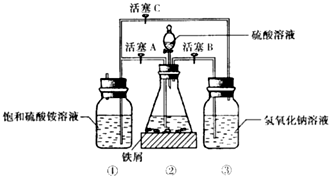 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
分析 Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应;
(3)亚铁离子能被空气中的氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气;
Ⅱ.在溶液中溶解度小的物质先析出;从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥.
解答 解:Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解,所以用氢氧化钠溶液煮沸的目的是除去铁屑中油污,
故答案为:除去铁屑中油污;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应,但硫离子在酸性溶液中不能以S2-形式大量存在,写离子方程式时不能用S2-,
故选:ABD;
(3)亚铁离子能被空气中的氧气氧化,所以要通入氢气,排除空气,防止亚铁离子被氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气,所以利用容器②的反应,向容器①中通入氢气,应先将气体通过氢氧化钠溶液,再通入容器①,所以应关闭活塞A,打开活塞BC,
故答案为:A;BC;吸收硫化氢气体,防止污染空气;防止亚铁离子被氧气氧化;
Ⅱ.根据表中的数据可知,硫酸亚铁、硫酸铵、硫酸亚铁铵三种物质中,硫酸亚铁铵的溶解度最小,所以硫酸亚铁铵在溶液中先析出,从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥,所以从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥,
故答案为:在相同温度下,硫酸亚铁铵的溶解度最小;过滤;用酒精洗涤;干燥.
点评 本题以莫尔盐的制备为载体,考察氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目有一定的难度,注意基础知识的全面掌握.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | Ba2++SO42-═BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
| A. | 可能只有甲烷 | B. | 可能只有氢气 | ||
| C. | 可能是甲烷和一氧化碳 | D. | 可能3种气体都存在 |
| A. | 不锈钢是利用牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | “绿色化学”的核心是使原料可能全部转化为目标产物 |
| A. | 降低温度,正反应速率减小、逆反应速率增大 | |
| B. | 增大c(A)、c(B),K增大 | |
| C. | 该反应的化学方程式为2E(g)+F(s)?A(g)+2B(g) | |
| D. | 该反应的焓变△H>0 |