题目内容
20.向KAl(SO4)2溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀,反应的离子方程式正确的是( )| A. | Ba2++SO42-═BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 使SO42-恰好完全沉淀,则二者以1:2反应,生成硫酸钡、偏铝酸钾,以此来解答.
解答 解:向KAl(SO4)2溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀,以1:2反应,生成硫酸钡、偏铝酸钾,离子反应为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握硫酸根离子完全沉淀时反应生成物为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
10.下列物质中,含氧原子最多的是( )
| A. | 标准状态时,22.4L的CO2 | B. | 200g49%的H3PO4 | ||
| C. | 32g 的SO2气体 | D. | 3.01×1023个O2分子 |
11.有一金属钠和过氧化钠的混和物,与过量水分反应后,产生2.24L气体(STP),用电火花点燃后,恢复到标准状态,体积减少了1.12L,则原混合物中钠与过氧化钠的物质的量之比( )
| A. | 1:3 | B. | 5:1 | C. | 1:1 | D. | 1:2 |
8.下列说法正确的是( )
| A. | 以下离子可存在于能使酚酞变红的溶液中:Na+,Ba2+,NO3-,Cl- | |
| B. | 以下离子可存在于含有0.1mol•L-1 Fe3+的溶液中:K+,Mg2+,I-,SO42- | |
| C. | 用氯水作为水的消毒剂的原理为:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 纯碱用于清洁厨具是由于它溶于水呈碱性的缘故:HCO3-+H2O?OH-+H2CO3 |
5.现有乙醇,乙二醇和丙三醇组成的混合物0.1mol,与足量的钠反应,在标准状况下生成2.24L氢气,该混合物中乙醇,乙二醇和丙三醇的物质的量之比不可能是( )
| A. | 1:1:1 | B. | 2:3:2 | C. | 3:5:3 | D. | 4:3:3 |
4.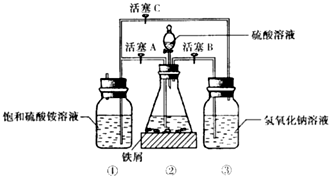 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
回答下列问题:
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.