题目内容
【题目】I.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为 。
(2)关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变 B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
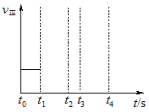
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇(化学式为CH3OH),CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为:![]() ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。
(2)已知在400℃时,N2(g)+3H2(g)![]() 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A、缩小体积增大压强 B、升高温度 C、加催化剂 D、使氨气液化移走
【答案】I.(1)0.002mol/(L·min);(2)ABC;(3)各1分
(4)CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol
Ⅱ(1)C(s)+H2O(g)![]() H2(g)+CO(g)(可不标状态)(2)=;A
H2(g)+CO(g)(可不标状态)(2)=;A
【解析】
试题分析:I.(1)因为是等体积,因此密度增大了0.12g·L-1,气体质量增大了3×0.12g=0.36g,根据质量差,求出消耗的H2O的物质的量0.36/12mol=0.03mol,v(H2O)=0.03/(3×5)mol/(L·min)=0.002 mol/(L·min);
(2)A、根据化学平衡状态的定义,CO的含量保持不变,说明反应达到平衡,A正确;B、v正(H2O)=v正(H2),说明正逆反应速率相等,反应达到平衡状态,B正确;C、根据摩尔质量的定义,气体的质量增大,气体的物质的量增大,因此摩尔质量不变,说明反应达到平衡,C正确,答案选ABC;
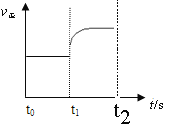
(3)①缩小容器的体积,增大压强,根据勒夏特列原理,平衡向逆反应方向移动,图像是: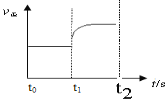 ;
;
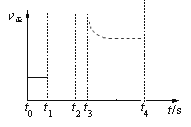
②平衡常数增大,只改变温度,说明化学反应向正反应方向移动,此反应是吸热反应,因此升高温度,图像是: ;
;
(4)①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,②CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1,③H2O(l)=H2O(g) △H=+44.0kJ·mol-1,CH3OH+O2=CO+2H2O(g),根据盖斯定律可知①-②+2×③得出:CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=(-725.8+283+2×44)kJ·mol-1=-354.8kJ·mol-1;
Ⅱ、(1)反应的平衡表达式为:![]() ,依据平衡常数概念和原子守恒,它所对应的化学方程式为:C(s)+H2O(g)
,依据平衡常数概念和原子守恒,它所对应的化学方程式为:C(s)+H2O(g)![]() H2(g) + CO(g);
H2(g) + CO(g);
(2)在400℃时,反应N2(g)+3H2(g)![]() 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,反应的Qc=
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,反应的Qc=![]() =0.5=K,说明反应达到平衡状态,v(N2)正=v(N2)逆;欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,可采取的正确措施是让化学平衡正向进行;A、反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡正向进行,NH3的体积分数增加,A正确;B、反应是放热反应,升高温度速率增大,平衡逆向进行,B错误;C、加催化剂改变化学反应速率,不改变化学平衡,C错误; D.使氨气液化移走,平衡正向进行,反应速率减小,D错误。答案选A。
=0.5=K,说明反应达到平衡状态,v(N2)正=v(N2)逆;欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,可采取的正确措施是让化学平衡正向进行;A、反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡正向进行,NH3的体积分数增加,A正确;B、反应是放热反应,升高温度速率增大,平衡逆向进行,B错误;C、加催化剂改变化学反应速率,不改变化学平衡,C错误; D.使氨气液化移走,平衡正向进行,反应速率减小,D错误。答案选A。