题目内容
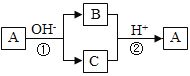
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
A. X元素不一定为非金属元素
B. 单质A可能是Cl2不能是S
C. 反应①和②一定为氧化还原反应
D. 反应①和②互为可逆反应
【答案】C
【解析】试题分析:由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应1应该是A物质的歧化反应,反应2应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S,应为非金属元素。A.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,故A错误;B.如A为Cl2,在碱性条件下反应生成Cl-和ClO-,二者在酸性条件下可生成Cl2,符合框图转化关系,如A为S,在碱性条件下反应生成S2-和SO32-,二者在酸性条件下可生成S,符合框图转化关系,故B正确;C.单质A生成化合物,元素的化合价发生变化,化合物生成A单质,化合价了发生变化,所以反应①和反应②一定属于氧化还原反应,故C正确;D.可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,上述①②两个反应的反应条件不相同,不是可逆反应,故D错误;故选C。

练习册系列答案
相关题目