题目内容
【题目】在一个2L的密闭容器中投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
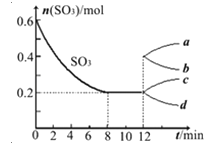
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
【答案】(1)0.4(2)0.0125mol/(Lmin)(3)B、C(4)C(5)逆;增大
【解析】
试题分析:(1) 2SO3(g)![]() 2SO2(g)+O2(g)
2SO2(g)+O2(g)
起始量(mol) 0.6 0 0
转化量(mol) 0.4 0.4 0.2
平衡量(mol) 0.2 0.4 0.2
平衡浓度(mol/L)0.1 0.2 0.1
根据该反应的平衡常数值为![]() =0.4。
=0.4。
(2)用O2表示0到8min内该反应的平均速率v=0.1mol/L÷8min=0.0125mol/(Lmin)。
(3)A、v(SO3)=2v(O2)中没有反应速率的方向,反应不一定达到平衡状态,A错误;B、正反应是体积增大的,则容器内压强保持不变,说明反应达到平衡状态,B正确;C、v(SO2)逆=2v(O2)正中正逆反应速率相等,说明反应达到平衡状态,C正确;D、容积和气体的质量均不变,因此密度是定值,则容器内密度保持不变不能说明反应达到平衡状态,D错误,答案选BC。
(4)在第12min时,容器压缩到1L,三氧化硫的浓度瞬间变为0.2mol/L,压强增大,平衡向逆反应方向进行,三氧化硫的浓度继续增大直至达到平衡状态,因此SO3的变化曲线为c曲线,答案选C。
(5)若保持容积不变在第12min时,加入SO3(g),则相当于增大压强,平衡向逆反应方向移动。SO3的体积分数增大。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1