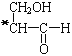题目内容
【题目】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是_______________,冷凝管的进水方向______(填“a”或“b”)。
(2)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 molL-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:____________________。
(4)硫酰氯在潮湿空气中“发烟”,原因是_______________________(用化学方程式表示)。
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为_______。
【答案】蒸馏烧瓶 a BD 2ClSO3H![]() SO2Cl2 + H2SO4 SO2Cl2+2H2O=H2SO4+2HCl 80%
SO2Cl2 + H2SO4 SO2Cl2+2H2O=H2SO4+2HCl 80%
【解析】
甲中产生二氧化硫,乙中除去二氧化硫中的杂质同时便于观察气流的速率;丙为两种气体混合反应的反应器;丁为除去氯气中的杂质同时便于观察气流速率;戊中贮存氯气,已为尾气吸收,防止空气中的水蒸气进入。据此回答。
(1) 仪器C的名称为蒸馏烧瓶。冷凝管的冷却水方向为从下进上出,所以进水方向为a。 (2) A.将70%硫酸换成98.3%硫酸,反应接触不充分,所以不能加快制取SO2的速率,故错误;B.实验中通过观察乙、丁导管口产生气泡的速率相等,可以使两种气体的体积相等,控制两种反应物体积相等,故正确;C.装置戊上方分液漏斗中最好选用饱和NaCl溶液,减小氯气的溶解度,故错误;D.装置最后用碱石灰吸收二氧化硫或氯气等有害气体,又能防止水蒸气进入,所以该装置己防止污染,又防止硫酰氯变质,故正确。故选BD。(3) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,根据质量守恒分析,方程式为:2ClSO3H![]() SO2Cl2 + H2SO4 。(4) 硫酰氯在潮湿空气中“发烟”,说明其与水发生反应,根据质量守恒或元素化合价分析,产物应为硫酸和盐酸,方程式为:SO2Cl2+2H2O=H2SO4+2HCl。(5) 二氧化硫体积为560 mL,其物质的量为0.56/22.4=0.025mol,2.7克硫酰氯的物质的量为2.7/135=0.02mol,则产率为0.02/0.025= 80%。
SO2Cl2 + H2SO4 。(4) 硫酰氯在潮湿空气中“发烟”,说明其与水发生反应,根据质量守恒或元素化合价分析,产物应为硫酸和盐酸,方程式为:SO2Cl2+2H2O=H2SO4+2HCl。(5) 二氧化硫体积为560 mL,其物质的量为0.56/22.4=0.025mol,2.7克硫酰氯的物质的量为2.7/135=0.02mol,则产率为0.02/0.025= 80%。