题目内容
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
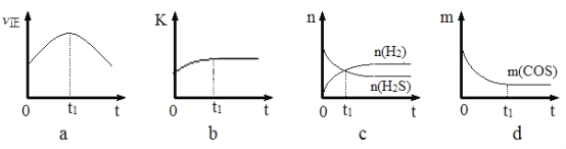
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
【答案】 ![]()
![]() CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol 减小 不变 bd 0.15 1.8
CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol 减小 不变 bd 0.15 1.8
【解析】(1). 羰基硫的结构与二氧化碳相似,二氧化碳的电子式为:![]() ,所以羰基硫的电子式为:
,所以羰基硫的电子式为:![]() ,硫是16号元素,硫原子的结构示意图为:
,硫是16号元素,硫原子的结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2). 已知:① COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol,② COS(g)+H2O(g)
H2S(g)+CO(g) ΔH1=+7kJ/mol,② COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol,③ 2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,根据盖斯定律,②+③÷2-①得:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol,故答案为:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol;
H2S(g)+CO2(g) ΔH2=-34kJ/mol,③ 2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,根据盖斯定律,②+③÷2-①得:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol,故答案为:CO(g)+1/2O2(g)===CO2(g) △H= -283kJ/mol;
(3). 氢解反应COS(g)+H2(g)![]() H2S(g)+CO(g)为反应前后气体分子数不变的可逆反应,平衡后保持温度和压强不变通入适量的He,容器体积增大,相当于减小压强,则正反应速率减小,因平衡不移动,所以COS的转化率不变,故答案为:减小;不变;
H2S(g)+CO(g)为反应前后气体分子数不变的可逆反应,平衡后保持温度和压强不变通入适量的He,容器体积增大,相当于减小压强,则正反应速率减小,因平衡不移动,所以COS的转化率不变,故答案为:减小;不变;
(4). a. t1时刻正反应速率仍然在变化,说明没有达到平衡状态,故a错误;b. 在绝热、恒容的密闭体系中发生氢解反应,t1时刻平衡常数不再变化,说明反应体系的温度不再变化,反应达到了平衡状态,故b正确;c. t1时刻氢气和硫化氢的物质的量相等,t1时刻之后二者的物质的量还在变化,说明反应没有达到平衡状态,故c错误;d. t1时刻COS的质量不再变化,说明反应达到了平衡状态,故d正确;答案选:bd;
(5). ①. 某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,由反应方程式COS(g)+H2O(g)![]() H2S(g)+CO2(g)可知,达到平衡时生成H2S的物质的量为:n(H2S)=2mol×75%=1.5mol,则用H2S表示的反应速率为:v(H2S)=1.5mol÷2L÷5min=0.15 mol/(Lmin),故答案为:0.15;
H2S(g)+CO2(g)可知,达到平衡时生成H2S的物质的量为:n(H2S)=2mol×75%=1.5mol,则用H2S表示的反应速率为:v(H2S)=1.5mol÷2L÷5min=0.15 mol/(Lmin),故答案为:0.15;
②. 根据平衡三段式法有:
COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
起始浓度(mol/L): 1 2 0 0
转化浓度(mol/L):0.75 0.75 0.75 0.75
平衡浓度(mol/L):0.25 1.25 0.75 0.75
则该温度下平衡常数K=![]() =1.8,故答案为:1.8。
=1.8,故答案为:1.8。



