题目内容
【题目】合成氨在生产中具有重要意义。请按要求回答下列问题。
(1)已知反应N2(g)+3H2(g)![]() 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
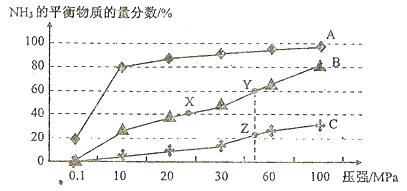
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)_______。图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”):K(X)__K(Y)_____K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有_______。
③Y点对应的H2的转化率是_______;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) _______ 。
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
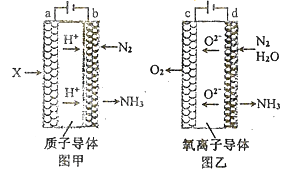
①图甲a电极上的电极反应式为_______图乙d电极上的电极反应式为_______。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
【答案】 A<B<C = > 加压或增大N2的浓度 75% 升高 H2-2e-=2H+ N2+3H2O+6e-=2NH3+3O2- 4:3
【解析】(1)因为正反应是吸热反应,相同压强下,投料相同升高温度平衡逆向移动,氨气的含量减小,所以①曲线A、B、C对应的温度是由低到高依次是. A<B<C。因为K只受温度影响,温度不变,化学反应平衡常数不变,图中X、Y在同一条曲线上所以平衡常数相等,Z点氨的转化率低,所以温度高,因为正反应是吸热反应,所以升高温度平衡逆向移动,平衡常数降低,所以X、Y、Z点的平衡常数大小关系K(X)=K(Y)>K(Z)。
②加快化学反应速率的因素是升高温度,增大压强、提高浓度,加催化剂;要提高H2的转化率需要化学平衡正向移动,结合两方面因素,可采取的措施有加压或增大N2的浓度。
③根据反应: N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
初始量(mol) 1 3 0
变化量(mol) x 3x 2x
Y点量(mol)1-x 3-3x 2x
Y点时氨气的质量分数为60%,所以[2x/(1-x+3-3x +2x)]![]() 100%=60% x=0.75mol,Y点对应的H2的转化率是为[(3
100%=60% x=0.75mol,Y点对应的H2的转化率是为[(3![]() 0.75mol)/3mol]
0.75mol)/3mol]![]() 100%=75%。若仅将起始投料均加倍,增大压强平衡正向移动,所以在其他条件不变,增加起始投料达新平衡时,则H2的转化率将升高。答案:75% 升高。
100%=75%。若仅将起始投料均加倍,增大压强平衡正向移动,所以在其他条件不变,增加起始投料达新平衡时,则H2的转化率将升高。答案:75% 升高。
(2)①根据图示甲可知电解时a为阳极,氢气在阳极放电生成氢离子,电极反应式为;H2-2e-=2H+,据图示乙可知电解时d电极为阴极,氮气和水在阴极放电生成氨气和O2-,电极反应式为:N2+3H2O+6e-=2NH3+3O2-;
②图甲中阴极电极反应式为:N2+6e-+6H+=2NH3,图乙中阴极电极反应式为:N2+3H2O+6e-= 2NH3+3O2-,生成1mol氨气,反应均转移3mol电子,则通电时间相同、电流强度相等,电解效率分别为80%和60%时,图甲和图乙装置生成的氨气的物质的量之比1×80%:1×60%=4:3。

【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。


