题目内容
【题目】聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如图:

(1)FeSO4溶液显弱酸性的原因是_____(用离子方程式表示)。
(2)加入浓硫酸调节pH的作用是:①_____;②_____。
(3)写出加入H2O2发生反应的离子方程式:_____。
(4)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl6,Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
①用HgCl2除去过量的SnCl2的目的是_____。
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol·L-1K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80mL。则聚铁中铁元素的质量分数为_____%。
(5)某高效净水剂是由K2FeO4得到的,工业上以硫酸铁溶液、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是_____。
【答案】Fe2++H2O![]() Fe(OH)2+2H+ 抑制Fe2+水解 提高H2O2的氧化能力(或促进Fe2+被氧化) 2Fe2++2H++H2O2=2Fe3++2H2O 防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差 21.5% Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O
Fe(OH)2+2H+ 抑制Fe2+水解 提高H2O2的氧化能力(或促进Fe2+被氧化) 2Fe2++2H++H2O2=2Fe3++2H2O 防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差 21.5% Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O
【解析】
(1)亚铁离子发生水解,破坏水的电离平衡使溶液呈酸性;
(2)根据亚铁离子在溶液中易水解及酸性条件下双氧水的氧化性增强进行分析;
(3)双氧水具有强氧化性,能够将亚铁离子氧化成铁离子,据此写出反应的离子方程式;
(4)①根据Sn2+能够还原![]() 而造成较大的实验误差进行判断;
而造成较大的实验误差进行判断;
②根据关系式6Fe2+~![]() 计算出亚铁离子物质的量,进而计算聚铁中铁的质量分数;
计算出亚铁离子物质的量,进而计算聚铁中铁的质量分数;
(5)根据氧化还原反应得失电子守恒和原子守恒写出其化学方程式。
(1)溶液中Fe2+离子发生水 Fe2++2H2O![]() 2H++Fe(OH)2,破坏水的电离平衡,溶液呈酸性,故答案为:Fe2++2H2O
2H++Fe(OH)2,破坏水的电离平衡,溶液呈酸性,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+;
Fe(OH)2+2H+;
(2)亚铁离子在溶液中容易发生水解,加入浓硫酸,增大溶液中氢离子,可以抑制Fe2+水解,下一步需要加入双氧水氧化亚铁离子,双氧水在酸性条件下氧化性增强,加入浓硫酸后可以提高双氧水的氧化能力,故答案为:抑制Fe2+水解;提高H2O2的氧化能力(或促进Fe2+被氧化);
(3)硫酸亚铁溶液中加入双氧水后,亚铁离子被双氧水氧化成铁离子,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)①Sn2+能够被![]() 氧化,所以为防止滴定过程中由于Sn2+同时还原
氧化,所以为防止滴定过程中由于Sn2+同时还原![]() 而造成较大的实验误差,需要用HgCl2除去过量的SnCl2,故答案为:防止滴定过程中由于Sn2+同时还原
而造成较大的实验误差,需要用HgCl2除去过量的SnCl2,故答案为:防止滴定过程中由于Sn2+同时还原![]() 而造成较大的实验误差;
而造成较大的实验误差;
② 由![]() 可知:
可知:
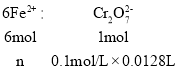 ,解得n=0.00768mol,故聚铁中铁的质量分数为:
,解得n=0.00768mol,故聚铁中铁的质量分数为: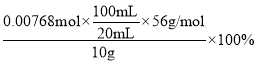 =21.5%;
=21.5%;
(5)硫酸铁被氧化成高铁酸钾,铁元素化合价升高3价,次氯酸钾被还原为氯化钾,氯元素化合价降低2价,故反应方程式中硫酸铁与次氯酸钾的系数之比为1:3,根据原子守恒配平其方程式为:Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O。

【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是____。
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)![]() 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①向某容器中充入1.0molH2O(g)和1.0molCO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
0 | 5min | 10min | 15min | 20min | 25min | |
Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是_____。
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图像正确且能说明可逆反应已达到平衡状态的是_____(填字母)。
A.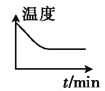 B.
B. C.
C.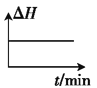 D.
D.
(4)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是___。若有标准状况下11.2LN2生成,共消耗ClO2___g。


