题目内容
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是____。
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)![]() 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①向某容器中充入1.0molH2O(g)和1.0molCO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
0 | 5min | 10min | 15min | 20min | 25min | |
Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是_____。
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图像正确且能说明可逆反应已达到平衡状态的是_____(填字母)。
A.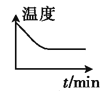 B.
B. C.
C.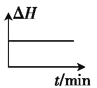 D.
D.
(4)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是___。若有标准状况下11.2LN2生成,共消耗ClO2___g。
【答案】CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol-1 0.2mol·L-1·min-1 1.25 增大压强(或加入催化剂) A 2NO+ClO2+H2O=NO2+HNO3+HCl 67.5
【解析】
(1)反应①:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol-1,
反应②:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·mol-1,
将②×2-①可得CH4(g)将NO(g)还原为N2(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=[(-867)×2-(-574)] kJ·mol-1=-1160kJ·mol-1;
(2)由题可列出三段式为:

5min内该反应的平均速率v(NO)=![]() =0.2 mol·L-1·min-1;平衡常数
=0.2 mol·L-1·min-1;平衡常数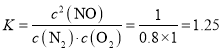 ;
;
(3)①由表格数据变化可知,在实验II反应中速率较快,最终平衡时CO的量一致,因此实验II该变的条件为加快化学反应速率但不该变平衡的条件,该反应为气体等体积反应,增加压强或者加入催化剂可达到该目的;
② A.该反应正向为放热反应,当加入CO2、H2后,反应逆向进行,其过程为吸热过程,因反应是在绝热体系中进行,因此随着反应的进行,体系内温度降低,当温度不再发生变化时,可说明反应达到平衡状态,故A符合题意;
B.该反应中H2随着反应的进行,其浓度将逐渐降低,故B不符合题意;
C.焓变与反应进行程度无关,因此无法根据焓变数据判断反应是否达到平衡状态,故C不符合题意;
D.该反应中所有物质均为气体物质,气体总质量不变,随着反应的进行,气体的物质的量不变,气体平均摩尔质量不变,因此无法根据气体平均摩尔质量判断反应是否达到平衡状态,故D不符合题意;
故答案为:A;
(4)由题可知,NO与ClO2反应,生成物为HNO3、NO、HCl,根据元素守恒可知反应物中含有水,根据氧化还原反应得失电子守恒以及原子守恒可知反应I的反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl;反应II为:2NO2+4Na2SO3=N2+4Na2SO4,标况下有11.2LN2(即0.5mol)生成,会消耗1molNO2,每生成1molNO2,会消耗ClO2的质量为:1mol×67.5g/mol=67.5g。

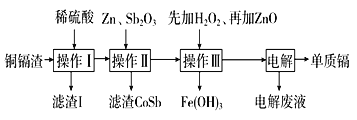
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,生产金属镉的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 mol/L)
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是__________。
(2)操作Ⅰ产生的滤渣主要成分为________(填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为______。
②再加入ZnO控制反应液的pH,pH范围为______。
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案鉴别________。
(4)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_________。