题目内容
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐。下列说法正确的是
| A.原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B.X的单质分子中存在s-pσ键 |
| C.测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D.Y的单质分子中有一个p-pσ键和二个p-pπ键 |
D
解析试题分析:甲的化学式为YX3,是一种刺激性气味的气体,该气体是氨气,则X是H,Y是N。X、W原子的最外层电子数与其电子层数相等,且W的原子序数最大,所以W应该是第三周期元素,因此W是铝元素。X、Z的最外层电子数之和与Y、W的最外层电子数之和相等,所以Z的最外层电子数是5+3-1=7。由于Z元素的原子序数介于Y和W之间,因此Z是氟元素。A、同周期自左向右原子半径之间减小,同主族自上而下原子半径逐渐增大,则原子半径:W>Y>Z。核外电子排布相同的微粒其微粒半径随原子序数的增大而减小,则离子半径:Y>Z>W,A不正确;B、氢原子只有s电子,因此氢气分子中不存在s-pσ键,B不正确;C、丙是由X、Y、Z组成的盐,则丙是NH4F。测得丙的水溶液呈酸性,这说明NH4+的水解程度强于F-的水解程度,所以溶液中丙盐阳离子浓度小于酸根离子浓度,C不正确;D、氮气分子中含有氮氮三键,三键是由1个σ键和2个π键构成的,因此氮气单质分子中有一个p-pσ键和二个p-pπ键,D正确,答案选D。
考点:考查元素周期表的结构、核外电子排布、共价键、微粒半径以及盐类水解

以下比较中,正确的是 ( )
| A.微粒半径:F->O2->Na+>Li+ | B.电负性Cl>C ,酸性:HClO4>H2CO3, |
| C.分子中的键角:CH4>H2O>CO2 | D.稳定性:LiCl<NaCl<KCl<RbCl |
下列关于原子结构、元素性质的说法正确的是 ( )
| A.ⅠA族金属元素是同周期中金属性最强的元素 |
| B.非金属元素组成的化合物中只含共价键 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.130 | 0.090 | 0.102 | 0.118 | 0.073 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+
C.元素最高价氧化物对应水化物的碱性:Y>R>X
D.单质与氢气化合的容易程度:Z>T
4p轨道电子排布达到半充满的元素,其原子序数是
| A.15 | B.33 | C.35 | D.51 |
短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是
| A.H3YO4 | B.H4YO4 | C.HYO2 | D.H2YO4 |
如图是元素周期表的一部分,下列关系正确的是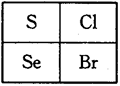
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |