题目内容
以下比较中,正确的是 ( )
| A.微粒半径:F->O2->Na+>Li+ | B.电负性Cl>C ,酸性:HClO4>H2CO3, |
| C.分子中的键角:CH4>H2O>CO2 | D.稳定性:LiCl<NaCl<KCl<RbCl |
B
解析试题分析: A.对于电子层数结构相同的离子来说,元素的核电荷数越大,半径越小;对于电子层数不同的元素来说,离子的电子层数越多,离子半径就越大。F-、 O2-、Na+的核外有两个电子层,核电荷数O2-< F-<Na+,Li+的核外只有一个电子层。所以微粒半径:O2->F->Na+>Li+ 。错误。 B.元素的非金属性越强,其电负性就越大,对应的最高价氧化物的水化物的酸性就越强。由于非金属性:Cl>C,所以电负性Cl>C ,酸性:HClO4>H2CO3。正确。C.分子中的键角:CH4:109°28´;H2O :104.3°;CO2::180 °。所以分子中的键角CO2>CH4>H2O。错误。D.Li、Na 、K、Rb都是碱金属,从上到下元素的原子半径逐渐增大,与Cl形成的离子键的键长就越大,化合物的稳定性就逐渐减弱。故稳定性:LiCl>NaCl>KCl>RbCl。错误。
考点:考查离子半径、元素的金属性、非金属性、分子中的键角及稳定性的比较的知识。

Y元素最高正价与负价的绝对值之差为4,Y元素与M元素可形成离子化合物,该物质能溶于水并在水中电离出电子层结构相同的离子,该化合物是
| A.硫化钾 | B.硫化钠 | C.氯化钠 | D.氧化铝 |
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是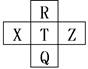
| A.非金属性:T<X <R |
| B.气态氢化物稳定性:R <T<Q |
| C.R与Q的电子数相差16 |
| D.X与Q最高价氧化物的水化物的质子数相差18 |
下表为元素周期表的一部分,有关说法正确的是
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
A.④、⑤、⑥、⑦、①的原子半径依次减小
B.⑤、⑥、⑧的最高价氧化物对应的水化物不能相互反应
C.⑦、②、③、④的氢化物的稳定性依次增强
D.②、③的气态氢化物均能与它们的最高价氧化物对应的水化物反应
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
| | 甲 | |
| | | |
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
| A.230Th的中子数比核外电子数多140 |
| B.230Th和232Th的化学性质相同 |
| C.232Th 转换成233U是化学变化 |
| D.Th 元素的相对原子质量是231 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐。下列说法正确的是
| A.原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B.X的单质分子中存在s-pσ键 |
| C.测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D.Y的单质分子中有一个p-pσ键和二个p-pπ键 |