��Ŀ����
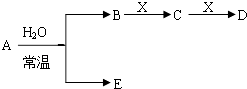
����Ŀ��һ�������¾���ͬ�Ļ�ѧ��Ӧ������ʵ��ͼʾ�仯��AΪ��ʽ�Σ�BΪ��ɫ��ζ���壻��ɫ����D��ʹ��ɫʯ����ֽ������X��F��YΪ���嵥�ʣ���YΪ��ɫ���壬FΪ��������Ҫ�ɷ�֮һ��GΪ���Σ�G����ɫ����M����Һ�пɷ�Ӧ����B����Ӧ���dz�����ҵԭ���� 
��1��д���������ʵĻ�ѧʽ��A��Y
��2��д����Ӧ�ڵ����ӷ���ʽ ��
��3��д����Ӧ�۵Ļ�ѧ����ʽ ��
��4��������pH=10�������Ϊ100mL��D��W����Һ��M��Ӧ�����ĵ�M�����ʵ�����ϵDW������ڡ���С�ڡ����ڡ�����
���𰸡�
��1��NH4HCO3��Cl2
��2��CO2+2OH��=CO32��+H2O
��3��2NH3+3Cl2=N2+6HCl
��4������
���������⣺��ɫ����D��ʹ��ɫʯ����ֽ��������DΪNH3 �� ���嵥��X��F��Ӧ�õ���������FΪ��������Ҫ�ɷ�֮һ������֪XΪH2��FΪN2 �� ���Z����Һ�õ�W����������ɫ���嵥��Y��Ӧ�ǵ��NaCl��Һ������֪WΪNaOH��YΪCl2 �� �����백����Ӧ����F������������ɫ����M������֪MΪHCl��AΪ��ʽ�Σ����ȷֽ�õ�D����������C����ɫ��ζ����B����B��W��Ӧ�õ�GΪ���Σ�G����ɫ����M����Һ�пɷ�Ӧ����B������֪BΪCO2 �� AΪNH4HCO3 �� CΪH2O��GΪNa2CO3 �� ��1��������������֪��AΪNH4HCO3 �� YΪCl2 �� ���Դ��ǣ�NH4HCO3��Cl2����2����Ӧ���Ƕ�����̼���������Ʒ�Ӧ����̼������ˮ�����ӷ���ʽΪ��CO2+2OH��=CO32��+H2O�����Դ��ǣ�CO2+2OH��=CO32��+H2O����3����Ӧ���������백����Ӧ���ɵ�����HCl����ѧ��Ӧ����ʽΪ��2NH3+3Cl2=N2+6HCl�����Դ��ǣ�2NH3+3Cl2=N2+6HCl����4��һˮ�ϰ�Ϊ������ʣ�������pH=10�İ�ˮ��NaOH��Һ����ˮ��Ũ��ԶԶ��������������Һ�������������Һ��HCl��Ӧ����ˮ���ĵ�HCl�����ʵ���Զ���������������ĵģ� ���Դ��ǣ����ڣ�

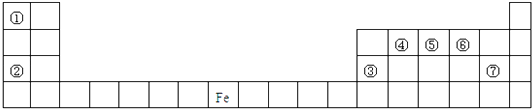
����Ŀ����ΪԪ�����ڱ���һ���֣���Ա��еĢ١������Ԫ�أ���ش��й����⣺
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1�����Ԫ�ط����� ��
��2������ЩԪ���У���ѧ��������õ�ԭ�ӽṹʾ��ͼΪ ��
��3����ЩԪ�ص�����������Ӧ��ˮ�����У�������ǿ�������ѧʽ����ͬ����������ǿ���� �� �����Ե��� ��
��4����Ԫ�آ�����Ԫ����ɵ�����л���͢ĵ��ʰ�1��1��Ϻ�������ڹ��������·���һ��ʱ�䣬����ܵõ����
��5���õ���ʽ��ʾ�ܺ͢���Ԫ���γɻ�����Ĺ���Ϊ ��